
【题目】甲烷、乙烯、环氧乙烷、丁烷都是重要的化工原料,用途广泛。回答下列问题:
已知:I.2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1=-206.6 kJ·mol-1
(g) △H1=-206.6 kJ·mol-1
II.CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1) △H2
III.2![]() (g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(g)+5O2(g)=4CO2(g)+4H2O(1) △H3
(1)若反应Ⅲ在一定温度下可自发进行,则△H3_____(填“>”“<”或“=”)0。
(2)热值是表示单位质量的燃料完全燃烧时所放出的热量,是燃料质量的一种重要指标。已知乙烯的热值为50.4 kJg-1,则△H3=___kJmol-1。
(3)实验测得2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1<0中,v逆=k逆c2(
(g) △H1<0中,v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
),v正=k正c2(CH2=CH2)c(O2)(k正、k逆为速率常数,只与温度有关)。
①达到平衡后,仅升高温度,k正增大的倍数_____(填“大于”“小于”或“等于”)k逆增大的倍数。
②若在1 L的密闭容器中充入1 mol CH2=CH2(g)和1 mo1O2(g),在一定温度下只发生反应I,经过10 min反应达到平衡,CH2=CH2(g)的转化率为40%,则010 min内v(O2)=_________,![]() =______(保留两位有效数字)。
=______(保留两位有效数字)。
(4)下列有关环氧乙烷制备的说法正确的是_____(填字母)。
A.由图1可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可得出乙烯的转化率受初始温度的影响不大
B.由图2可知,原料气的流速加快,乙烯转化率下降,主要是原料气与催化剂接触时间过短造成
C.若进料气中氧气比例增大,环氧乙烷产率降低,其主要原因是部分乙烯、环氧乙烷转化为二氧化碳和水

(5)一种以天然气为燃料的固体氧化物燃料电池的原理如图所示,其中YSZ为6%~10%Y2O3掺杂的ZrO2固体电解质。
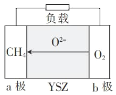
a极上的电极反应式为_____;若电路中转移0.1 mol电子,则消耗标准状况下CH4的体积为_____L。
【答案】< -2615.8 小于 0.02 mol/(L·min) 0.56 BC CH4-8e-+4O2-=CO2+2H2O 0.28
【解析】
(1)反应Ⅲ是体系混乱程度减少的反应△S<0,若在一定温度下反应可自发进行,根据△G=△H-T△S<0,△S<0,则△H<0;
(2)乙烯的热值为50.4 kJg-1,则1 mol乙烯的燃烧热为-50.4 kJg-1×28 g/mol=-1411.2 kJ/mol,根据盖斯定律,将(I+III)÷2,整理可得CH2=CH2(g)+3O2(g)=2CO2(g)+2H2O(1),△H=![]() =-1411.2 kJ/mol,所以△H3=2△H-△H1=2×(-1411.2 kJ/mol)-(-206.6 kJ/mol)=-2615.8 kJ/mol;
=-1411.2 kJ/mol,所以△H3=2△H-△H1=2×(-1411.2 kJ/mol)-(-206.6 kJ/mol)=-2615.8 kJ/mol;
(3)反应2CH2=CH2(g)+O2(g)![]() 2
2![]() (g) △H1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正增大的多,使得v正<v逆,所以化学平衡逆向移动。v逆=k逆c2(
(g) △H1<0的正反应是放热反应,在其他条件不变时,升高温度,v正、v逆都增大,由于温度对吸热反应影响更大,所以v逆增大的比v正增大的多,使得v正<v逆,所以化学平衡逆向移动。v逆=k逆c2(![]() ),v正=k正c2(CH2=CH2)c(O2),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
),v正=k正c2(CH2=CH2)c(O2),因此达到平衡后,仅升高温度,k正增大的倍数小于k逆增大的倍数;
②根据方程式可知乙烯与氧气反应的物质的量的比是2:1,由于开始时加入了1 mol乙烯,达到平衡时乙烯转化率为40%,则反应的乙烯的物质的量为1 mol×40%=0.4 mol,所以反应的氧气的物质的量是0.2 mol,故010 min内v(O2)=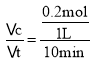 =0.02 mol/(L·min);反应达到平衡时c(CH2=CH2)=(1 mol-0.4 mol)÷1 L=0.6 mol/L,c(O2)=(1 mol-0.2mol)÷1 L=0.8 mol/L,c(
=0.02 mol/(L·min);反应达到平衡时c(CH2=CH2)=(1 mol-0.4 mol)÷1 L=0.6 mol/L,c(O2)=(1 mol-0.2mol)÷1 L=0.8 mol/L,c(![]() )=0.4 mol÷1 L=0.4 mol/L,化学平衡常数K=
)=0.4 mol÷1 L=0.4 mol/L,化学平衡常数K=![]() =
=![]() ;由于反应达到平衡时v正=v逆,所以k正c2(CH2=CH2)c(O2)= k逆c2(
;由于反应达到平衡时v正=v逆,所以k正c2(CH2=CH2)c(O2)= k逆c2(![]() ),故
),故![]() =
=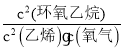 =K=
=K=![]() =0.56;
=0.56;
(4)A.根据图示可知,进料气体的初始温度对环氧乙烷的选择性影响不大,可能是温度对副反应的影响较小造成的,但不能得到初始温度对乙烯的转化率影响不大的结论,实际上升高温度,物质转化率相对有较大影响,A错误;
B.流速越快,反应物接触时间越短,消耗乙烯的量越少,导致乙烯转化率下降,B正确;
C.若进料气中O2比例增大,环氧乙烷产率降低,其主要原因是环氧乙烷与氧气发生副反应转化为二氧化碳和水,C正确;
故合理选项是BC;
(5)根据图示可知在a电极通入甲烷为负极,失去电子发生氧化反应,电极反应式为CH4-8e-+4O2-=CO2+2H2O,每有1 molCH4发生反应,转移8 mol电子;若电路中转移0.1 mol电子,消耗CH4的物质的量为n(CH4)=![]() ×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=n·Vm=0.0125 mol×22.4 L/mol=0.28 L。
×0.1 mol=0.0125 mol,其在标准状况下的体积V(CH4)=n·Vm=0.0125 mol×22.4 L/mol=0.28 L。


 名校联盟快乐课堂系列答案
名校联盟快乐课堂系列答案 黄冈创优卷系列答案
黄冈创优卷系列答案科目:高中化学 来源: 题型:
【题目】为提升电池循环效率和稳定性,科学家近期利用三维多孔海绵状Zn(3D-Zn)可以高效沉积ZnO的特点,设计了采用强碱性电解质的3D-Zn-NiOOH二次电池,结构如图所示。电池反应为Zn(s)+2NiOOH(s)+H2O(l)![]() ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )
ZnO(s)+2Ni(OH)2(s)。下列说法错误的是( )

A.三维多孔海绵状Zn具有较高的表面积,所沉积的ZnO分散度高
B.放电时正极反应为NiOOH(s)+H2O(l)+e-=Ni(OH)2(s)+OH-(aq)
C.放电时负极反应为Zn(s)+2OH-(aq)-2e-=ZnO(s)+H2O(l)
D.放电过程中OH-通过隔膜从负极区移向正极区
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.  Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
B.  正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
正极的电极反应式为Ag2O+2e+H2O2Ag+2OH
C.  锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄
D.  使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
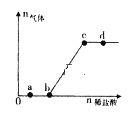
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“人文奥运”的一个重要体现是:坚决反对运动员服用兴奋剂。某种兴奋剂的结构简式如图所示,有关该物质的说法正确的是( )
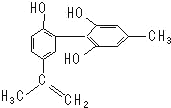
A.遇FeCl3溶液显紫色,因为该物质与苯酚属于同系物
B.滴入KMnO4(H+)溶液,观察紫色褪去,能证明结构中存在碳碳双键
C.1mol该物质与浓溴水和H2反应最多消耗Br2和H2分别为4mol、7mol
D.该分子中的所有原子可能共平面
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钒“现代工业的味精”,是发展现代工业、现代国防和现代科学技术不可缺少的重要材料,其氧化物二氧化钒(VO2)是一种新型热敏材料,五氧化二钒(V2O5)是接触法生成硫酸的催化剂.下列某化学小组从废钒催化剂(V2O5、V2O4、K2SO4、SiO2、Fe2O3、Al2O3等)中回收V2O5并且利用回收的V2O5制备VO2的氧钒(Ⅳ) 碱式碳酸铵晶体
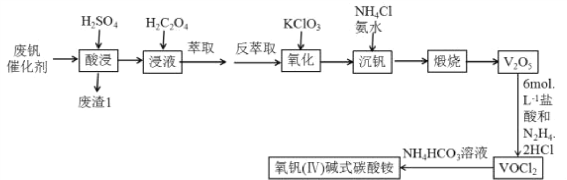
已知:①“酸浸”时V2O5转化为VO2+,V2O4转成VO2+
②有机萃取剂萃取VO2+的能力比萃取VO2+要强。
③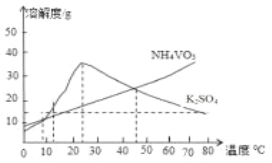
回答下列问题:
(1)写出“废渣1”的主要成分的用途________(填两条)。
(2)“萃取”之前加入H2C2O4的主要目的_____________________。
(3)“氧化”过程中发生的离子方程式___________________________。
(4)该工艺中加入氯化铵“沉钒”是回收钒的关键之一,加入氯化铵、氨水之后的操作是____________,该流程用到了过滤操作,过滤和萃取分液都需用到的一种玻璃仪器是__________。
(5)工艺中生成VOC12的同时生成一种无色无污染的气体,该反应中氧化产物与还原产物的物质的量之比为___________;也可只用浓盐酸与V2O5来制备VOC12 溶液,该方法的化学方程式是________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有八种短周期主族元素x、y、z、d、e、f、g、h,其中x、y、d、f随着原子序数的递增,其原子半径的相对大小、最高正价或最低负价的变化如图1所示。 z、e、g、h的最高价氧化物对应水化物溶液(浓度均为0.01mol/L)的pH与原子序数的关系如图2所示。
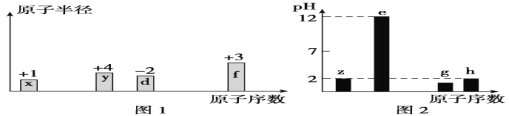
根据上述信息进行判断,下列说法正确是( )
A.d、e、f、g 形成的简单离子中,半径最大的是d离子
B.d与e形成的化合物中只存在离子键
C.x、y、z、d、e、f、g、h的单质中,f的熔点最高
D.x与y可以形成多种化合物,可能存在非极性共价键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物X的分子式为C5H11Cl,用NaOH的醇溶液处理X,可得分子式为C5H10的两种产物Y、Z,Y、Z经催化加氢后都可得到2甲基丁烷。若将化合物X用NaOH的水溶液处理,则所得有机产物的结构简式可能是( )
A.CH3CH2CH2CH2CH2OH B.(CH3)2COHCH2CH3
C.(CH3)2CHCH2CH2OH D.(CH3)3CCH2OH
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法错误的是( )
A.用惰性电极电解 Na2SO4 溶液,当 2 mol 电子转移时,可加入 18 g 水恢复
B.用惰性电极电解 1 L 1 mol/L CuSO4 溶液,当加入 1 mol Cu(OH)2 恢复电解前浓度时, 电路中转移了 4 mol e-
C.用惰性电极电解 1 mol CuSO4 和 1 mol NaCl 的混合溶液,溶液的 pH 先减小后增大
D.要想实现 Cu+H2SO4(稀) ═ CuSO4+H2↑的反应,需在电解池中进行,且 Cu 为阳极
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com