
【题目】向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
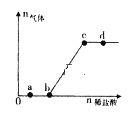
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
【答案】C
【解析】
向Na2CO3、NaHCO3,a点溶液中含有CO32-和HCO3-,b点全部为HCO3-,c点恰好完全反应生成NaCl,溶液呈中性,d点盐酸过量,呈酸性。
A.a点溶液中含有CO32-和HCO3-,HCO3-与OH-反应,不能大量共存,故A错误;
B.b点全部为HCO3-,Al3+、Fe3+与HCO3-发生互促水解反应,不能大量共存,故B错误;
C.c点恰好完全反应生成NaCl,溶液呈中性,离子之间不发生任何反应,可大量共存,故C正确;
D.d点呈酸性,酸性条件下,NO3-与Fe2+能够发生氧化还原反应,不能大量共存,F-在酸性条件下也不能大量存在,故D错误;
故选C。


科目:高中化学 来源: 题型:
【题目】一定量的CuS和Cu2S的混合物投入足量的HNO3中,收集到气体VL(标况下),向反应后的溶液中(存在Cu2+和SO42-)加入足量NaOH,产生蓝色沉淀,过滤,洗涤,灼烧,得到CuO12.0g,若上述气体为NO和NO2的混合气体,且体积比为1:1,则V可能为( )
A.8.4LB.13.5LC.10.7LD.16.8L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学在实验室欲配制物质的量浓度均为1.0mol/L的NaOH溶液、稀硫酸各450ml.提供的试剂是:NaOH固体、98%的浓硫酸(密度为1.84g/cm3)和蒸馏水.

(1)请你观察图示判断其中不正确的操作有_________(填序号).
(2)应用托盘天平称量NaOH_______g,应用量筒量取浓硫酸________mL.
(3)浓硫酸溶于水的正确操作方法是_________________________
(4)在配制H2SO4溶液实验中,下列操作引起结果偏高的有___________
A.该学生在量取浓硫酸时,俯视刻度线
B.溶解硫酸后没有冷却至室温就立即完成后面的配制操作
C.在烧杯中溶解搅拌时,溅出少量溶液
D.没有用蒸馏水洗涤烧杯2~3次,并将洗液移入容量瓶中
E.将量筒洗涤2~3次,并全部转移至容量瓶中
F.容量瓶中原来存有少量蒸馏水
G.胶头滴管加水定容时俯视刻度
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在标准状况下,将224L氯化氢气体完全溶于635mL的水(密度为1g/cm3)中,所得盐酸的密度为1.18g/cm3,该溶液中溶质的物质的量是多少__?该盐酸中溶质的质量分数是多少__?
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三种气体X、Y、Z的相对分子质量关系为Mr(X)<Mr(Y)=0.5Mr(Z),下列说法正确的是
A. 原子数目相等的三种气体,质量最大的是Z
B. 同温同压下,同质量的三种气体,气体密度最小的是X
C. 若一定条件下,三种气体体积均为2.24 L,则它们的物质的量一定均为0.1 mol
D. 同温下,体积相同的两容器分别充2 g Y气体和1 g Z气体,则其压强比为2︰1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】粉煤灰是燃煤电厂的废渣,主要成分为SiO2、Al2O3、Fe2O3和C等。实验室模拟工业从粉煤灰提取活性Al2O3,其流程如下图:
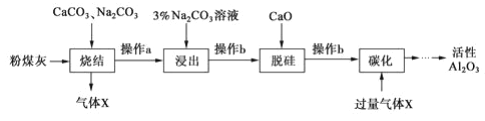
已知烧结过程的产物主要是NaAlO2、Ca2SiO4、NaFeO2和Na2SiO3等。
(1)写出烧结过程中铝元素转化的化学方程式___。
(2)操作 a 为冷却、研磨,其中研磨的目的是___。
(3)①浸出过程中, NaFeO 2 可完全水解,生成沉淀为___。
②3%Na2 CO3溶液显___(填 “酸性 ”、 “碱性 ”或“中性 ”),请用离子方程式解释:___。
(4)操作b 所用的玻璃仪器有漏斗、___、___。
(5)“碳化”时,通入过量气体 x 主要成分的化学式为___。
(6)工业上电解Al2O3制备 Al 是为使Al2O3在较低温下融化,通常加入___。电解过程中做阳极的石墨易消耗,原因是___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】孔雀石主要含Cu2(OH)2CO3,还含少量Fe、Si的化合物。某工厂以孔雀石为主要原料制备CuSO4·5H2O,主要步骤如下:
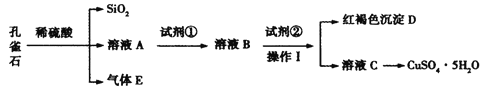
已知该条件下,通过调节溶液的酸碱性而使 Fe3+、Fe2+、Cu2+生成沉淀的 pH 分别如下:
物质 | 开始沉淀时的pH | 完全沉淀时的pH |
Fe(OH)3 | 2.2 | 3.2 |
Fe(OH)2 | 7.6 | 9.6 |
Cu(OH)2 | 4.7 | 6.4 |
请回答下列问题:
(1)为了提高孔雀石酸浸时的速率,除适当增加浓硫酸浓度外,还可以采取的措施有:___(写一种)。
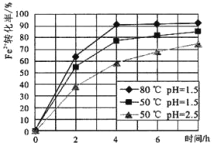
(2)试剂①是双氧水,把 Fe2+氧化成 Fe3+的目的是___。根据如图有关数据,你认为工业上氧化操作时应采取的条件是___。
(3)试剂②为CuO,其目的是调节溶液的 pH 保持在___范围。操作Ⅰ的名称是___。
(4)溶液 C 得到CuSO4·5H2O的主要步骤是___、___、过滤、洗涤、干燥。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】人工光合系统装置(如图)可实现以CO2和 H2O 合成CH4。下列有关说法不正确的是()

A. 该装置中铜为正极
B. 电池工作时H+向Cu电极移动
C. GaN 电极表面的电极反应式为: 2H2O-4e-═O2+4H+
D. 反应CO2+2H2O═CH4+2O2中每消耗 1mol CO2转移 4mol e-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室用NaOH固体配制1.0mol·L-1的NaOH溶液450mL,回答下列问题:
(1)实验步骤:
①计算所需称量的NaOH的质量为___g。
②用托盘天平称量NaOH固体,称量时应将NaOH置于烧杯中放在天平___盘称量。
③将称得的固体放于烧杯中,并加水溶解。
④检查容量瓶不漏水后,立即用玻璃棒引流转移溶液进入___mL容量瓶中。
⑤用少量水洗涤___2-3次;并将洗涤液转移进容量瓶。
⑥用玻璃棒引流向容量瓶中加水,至液面离刻度线1-2cm时,改用胶头滴管滴加至凹液面最低点与刻度线相平。
⑦翻转摇匀后转入试剂瓶中储存。
(2)以上步骤有一步操作不当,写出序号并改正___。
(3)下列操作导致所配溶液的浓度偏大的有___。
A.NaOH中混有Na2O
B.氢氧化钠已潮解
C.容量瓶未干燥即用来配制溶液
D.往容量瓶中移液时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时俯视刻度线
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com