
【题目】实验室用NaOH固体配制1.0mol·L-1的NaOH溶液450mL,回答下列问题:
(1)实验步骤:
①计算所需称量的NaOH的质量为___g。
②用托盘天平称量NaOH固体,称量时应将NaOH置于烧杯中放在天平___盘称量。
③将称得的固体放于烧杯中,并加水溶解。
④检查容量瓶不漏水后,立即用玻璃棒引流转移溶液进入___mL容量瓶中。
⑤用少量水洗涤___2-3次;并将洗涤液转移进容量瓶。
⑥用玻璃棒引流向容量瓶中加水,至液面离刻度线1-2cm时,改用胶头滴管滴加至凹液面最低点与刻度线相平。
⑦翻转摇匀后转入试剂瓶中储存。
(2)以上步骤有一步操作不当,写出序号并改正___。
(3)下列操作导致所配溶液的浓度偏大的有___。
A.NaOH中混有Na2O
B.氢氧化钠已潮解
C.容量瓶未干燥即用来配制溶液
D.往容量瓶中移液时,有少量液体溅出
E.未洗涤溶解NaOH的烧杯
F.定容时俯视刻度线
【答案】20.0 左 500 烧杯和玻璃棒 ④错误,应将溶液冷却后再移液 AF
【解析】
根据题中实验室用NaOH固体配制1.0mol·L-1的NaOH溶液450mL可知,本题考查配制一定物质的量浓度溶液的配制,运用配制一定物质的量浓度溶液操作步骤分析。
(1)由于实验室无450mL容量瓶,故应选用500mL容量瓶,配制出500mL溶液。
①配制500mL1.0mol/L的NaOH溶液所需的氢氧化钠的质量![]() ,
,
故答案为:20.0
②用托盘天平称量时应为左物右码,故称量时应将NaOH置于烧杯中放在天平左盘称量。
故答案为:左
④由于实验室无450mL容量瓶,应选用500mL容量瓶。
故答案为:500;
⑤为防止溶质损失,应洗涤烧杯和玻璃棒23次,洗涤液也转移入容量瓶中。
故答案为:烧杯和玻璃棒。
(2)氢氧化钠溶于水后放热,应将溶液冷却后移液,即④错误,而不能将溶解后的氢氧化钠立即转移到容量瓶中。
故答案为:④错误,应将溶液冷却后再移液
(3)A.NaOH中混有Na2O,Na2O会与水反应生成NaOH,导致氢氧化钠的物质的量偏大,则浓度偏高,故A正确;
B. 氢氧化钠已潮解,会导致氢氧化钠的真实的质量偏低,则浓度偏低,故B错误;
C. 容量瓶未干燥即用来配制溶液,对浓度无影响,故C错误;
D. 往容量瓶中移液时,有少量液体溅出,会导致溶质的损失,则浓度偏小,故D错误;
E. 未洗涤溶解NaOH的烧杯,会导致溶质的损失,则浓度偏低,故E错误;
F. 定容时俯视刻度线,会导致溶液体积偏小,则浓度偏高,故F正确。
故答案为:AF.


科目:高中化学 来源: 题型:
【题目】向Na2CO3、NaHCO3,混合溶液中逐滴加入稀盐酸,生成气体的量随盐酸加入量的变化关系如图所示。则下列离子组在对应的溶液中一定能大量共存的是
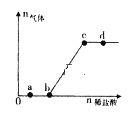
A. a点对应的溶液中:Na+、OH-、SO42-、NO3-
B. b点对应的溶液中:Al3+、Fe3+、MnO4-、Cl-
C. c点对应的溶液中:Na+、Ca2+、NO3-、Cl-
D. d点对应的溶液中:F-、NO3-、Fe2+、Ag+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究表明:丰富的 CO2 可以作为新碳源,解决当前应用最广泛的碳源(石油和天然气)枯竭危机,同时又可缓解由 CO2累积所产生的温室效应,实现 CO2的良性循环。
(1)目前工业上有一种方法是用CO2加氢合成低碳烯烃。现以合成乙烯(C2H4)为例、该过程分两步进行:
第一步:CO2(g)+H2(g)![]() CO(g)+H2O(g)△H=+41.3kJ/mol
CO(g)+H2O(g)△H=+41.3kJ/mol
第二步:2CO(g)+4H2(g)![]() C2H4(g)+2H2O(g)△H=-210.5kJ/mol
C2H4(g)+2H2O(g)△H=-210.5kJ/mol
①CO2加氢合成乙烯的热化学方程式为___。
②一定条件下的密闭容器中,上述反应达到平衡后,要加快反应速率并提高 CO2 的转化率,可以采取的措施是___(填字母)。
A.减小压强 B.增大 H2浓度 C.加入合适的催化剂 D.分离出水蒸气
(2)另一种方法是将 CO2 和 H2 在 230℃催化剂条件下生成甲醇蒸气和水蒸气,在不同条件下测得平衡时甲醇的物质的量随温度、压强的变化如图所示。若在 10L 恒容密闭容器中投入1molCO2 和 2.75molH2,发生反应: CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g)。
CH3OH(g)+H2O(g)。
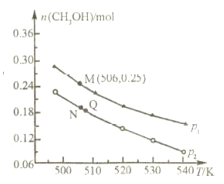
①能判断该反应达到化学平衡状态的是___(填字母)。
A.c(H2):c(CH3OH)=3:1
B.容器内氢气的体积分数不再改变
C.容器内气体的密度不再改变
D.容器内压强不再改变
②上述反应的△H___0(填“>”或“<”),图中压强 p1 ___p2(填“>”或“<”)。
③经测定知 Q 点时容器的压强是反应前压强的 9/10,则 Q 点 CO2的转化率为___。
④M 点时,该反应的平衡常数 K=___ (计算结果保留两位小数)。
(3)用生石灰吸收 CO2 可生成难溶电解质 CaCO3,其溶度积常数 Ksp=2.8×10-9。现有一物质的量浓度为2×10-4mol/L 纯碱溶液,将其与等体积的 CaCl2溶液混合,则生成沉淀所需 CaCl2溶液的最小浓度为___mol/L。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知3X(g)+Y(g) ![]() W(g)+2M(g) ΔH=-akJ/mol(a﹥0)。一定温度下,在体积恒定的密闭容器中,加入3mol X(g)与1mol Y(g),下列说法正确的是( )
W(g)+2M(g) ΔH=-akJ/mol(a﹥0)。一定温度下,在体积恒定的密闭容器中,加入3mol X(g)与1mol Y(g),下列说法正确的是( )
A. 充分反应后,放出热量为akJ
B. 当反应达到平衡状态时,X与W的物质的量浓度之比一定为3∶1
C. 当X的物质的量分数不再改变,表明该反应已达平衡
D. 若增大Y的浓度,正反应速率增大,逆反应速率减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A. ![]() 氨水加水稀释后,溶液中所有离子的浓度都减小
氨水加水稀释后,溶液中所有离子的浓度都减小
B. 将![]() 溶液与
溶液与![]() 溶液混合可制取
溶液混合可制取![]()
C. 直接蒸干![]() 溶液就可以得到
溶液就可以得到![]() 固体
固体
D. 浓度相同的①![]() ;②
;②![]() ;③
;③![]() 。三种溶液中的
。三种溶液中的![]() :③>①>②
:③>①>②
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用如图装置进行实验:加热钠至熔化后,停止加热并通入氯气,钠剧烈燃烧并生成大量白烟。以下叙述错误的是
![]()
A.棉花球处发生的离子反应是Cl2+H2O = H++Cl-+HClO
B.大量白烟是氯化钠固体小颗粒
C.钠着火燃烧产生黄色火焰
D.可在棉花球右侧用湿润的淀粉KI试纸判断氯气是否被碱液完全吸收
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某同学用邻苯二甲酸氢钾溶液来滴定NaOH溶液有下列操作:
①向溶液中加入1~2滴指示剂
②取20.00 mL标准溶液放入锥形瓶中
③用NaOH溶液滴定至终点(终点时溶液的pH约为9.1)
④重复以上操作
⑤用天平精确称取一定量的邻苯二甲酸氢钾固体配成250 mL标准溶液(测得pH约为4.2)
⑥根据实验数据计算NaOH的物质的量浓度
(1)以上各步中,正确的(填序号)操作顺序是________,上述②中使用的仪器除锥形瓶外,还需要使用的仪器是________,选用指示剂是________。
(2)滴定,并记录NaOH的终读数.重复滴定几次,数据记录如下表:

某同学在处理数据过程中计算得到平均消耗NaOH溶液的体积为V(NaOH)=(19.98+20.00+20.80+20.02)/4mL=20.20mL,他的计算合理吗?理由是__________。
(3)步骤②中在观察滴定管的起始读数时,要使滴定管的尖嘴部分充满溶液,如果滴定管内部有气泡,赶走气泡的操作__________;滴定前用蒸馏水洗净碱式滴定管,然后加NaOH溶液进行滴定,此操作对实验结果________(填“偏大”、“偏小”或“无影响”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、某有机物的分子式为C6H12,若其分子中所有碳原子一定处于同一平面,则该有机物的结构简式为________;若该有机物有一个顺式异构体,且能与氢气加成生成2-甲基戊烷,则该顺式异构体的结构简式为___________。
Ⅱ、玫瑰的香味物质中包含苧烯,苧烯的键线式为![]() 。苧烯的分子式为________。有机物A是苧烯的同分异构体,分子中含有
。苧烯的分子式为________。有机物A是苧烯的同分异构体,分子中含有![]() 结构,A可能的结构为____(用键线式表示)。
结构,A可能的结构为____(用键线式表示)。
Ⅲ、某物质的分子式为C7H6O2 ,其同分异构体既能发生银镜反应,又能与FeCl3溶液发生显色反应,写出符合上述条件的同分异构体的结构简式________________。
通过此题的解答,请归纳你在书写同分异构体时应用的规律_______ 、 _______ 、 _______(至少两点)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图所示为800 ℃时A、B、C三种气体在密闭容器中反应时浓度的变化,只从图上分析不能得出的结论是( )
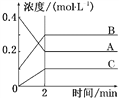
A. A是反应物
B. 前2 min A的分解速率为0.1 mol·L-1·min-1
C. 达平衡后,若升高温度,平衡向正反应方向移动
D. 反应的方程式为2A(g)![]() 2B(g)+C(g)
2B(g)+C(g)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com