
(1)(4分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g)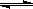 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:

①该反应的△H_____0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求CO的平衡转化率= ________。
(2)(3分)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式
___________________________________________。
(3)(3分)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的c(H+)之比为 。
(4)(3分)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1 mol·L-1 HF溶液中c(H+)= mol·L-1。
(16分)
(1)(4分)< 60%
(2)(3分)M++H2O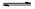 MOH+H+
MOH+H+
(3)(3分)1:10:100:1
(4)(3分)6×10-3
(5)(3分)7
【解析】
试题分析::(1)①由表中数据可知,温度越高平衡常数越小,故升高温度平衡向逆反应移动,正反应为放热反应,即△H<0。②令平衡时CO的物质的量变化为nmol,则:
1/3Fe2O3(s)+CO(g)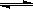 2/3Fe(s)+CO2(g)
2/3Fe(s)+CO2(g)
开始(mol):1 1
变化(mol):n n
平衡(mol):1-n 1+n
所以(1+n)/(1-n) =4,解得n=0.6,
所以n(CO)=0.6mol÷1mol×100%=60%。
(2)依据盐类的规律“谁弱谁水解,谁强显谁性”,MR是弱酸强碱盐,故水解反应的离子方程式为M++H2O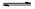 MOH+H+。
MOH+H+。
(3)四种溶液中由水电离产生的c(H+)分别为:10-14、10-13、10-12、10-14,之比为1:10:100:1。
(4)电离常数Ka(HF)=c(H+)×c(F-)÷c(HF) =3.6×10-4,c(HF)=" 0.1" mol·L-1,c(H+)=c(F-),故c(H+)=6×10-3。
(5)(3分)在温度t ℃时,pH=3的某水溶液中c(OH-)=10-8 mol/L。在此温度下5×10—5mol/LBa(OH)2溶液的pH= 。
(5)在温度t ℃时,离子积常数K= c(OH-)×c(H+)=10-3 (mol/L)×10-8 (mol/L) =10-11 (mol/L)2。5×10—5mol/LBa(OH)2溶液中,c(OH-)=10-4 mol/L,根据K= c(OH-)×c(H+),得c(H+)= 10-7 mol/L,pH=7。
考点:化学平衡常数 转化率 盐类的水解 水的电离 水的离子积常数
点评:本题考查的是综合的知识,题目难度中,注意基础知识的学习、掌握及应用。


科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
查看答案和解析>>
科目:高中化学 来源: 题型:
| 1 |
| 3 |
| 2 |
| 3 |
| 温度/℃ | 1000 | 1150 | 1300 |
| 平衡常数 | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
查看答案和解析>>
科目:高中化学 来源:2012-2013学年云南省昆明三中、滇池中学高二下学期期中考试化学试卷(本部)(带解析) 题型:填空题
(1)(4分)高炉炼铁过程中发生的主要反应为:1/3Fe2O3(s)+CO(g) 2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
2/3Fe (s)+CO2(g),已知该反应在不同温度下的平衡常数如下。则:
①该反应的△H_____0(填“>”、“<”或“=”);
②在一个容积为10L的密闭容器中,1000℃时加入Fe、Fe2O3、CO、CO2各1.0 mol,反应经过l0 min后达到平衡。求CO的平衡转化率= ________。
(2)(3分)常温下,HR(酸)溶液pH=3,MOH(碱)的溶液pH=11,两者等体积混合后溶液显碱性。则混合溶液中必定有一种离子能发生水解,该水解反应的离子方程式
___________________________________________。
(3)(3分)25℃时,pH=0的HCl、0.1mol/L的HCl、0.01mol/L的NaOH、pH=14的NaOH四种溶液中由水电离产生的c(H+)之比为 。
(4)(3分)已知25℃时,电离常数Ka(HF)=3.6×10-4,则0.1 mol·L-1 HF溶液中c(H+)= mol·L-1。
查看答案和解析>>
科目:高中化学 来源:2013-2014学年重庆市五区高三第一次学生学业调研抽测理综化学试卷(解析版) 题型:填空题
铁元素及其化合物与人类的生产生活息息相关,试回答下列问题:
(1)电子工业常用30%的FeCl3溶液腐蚀敷在绝缘板上的铜箔,制造印刷电路板,该反应的离子方程式为 。
(2)已知:Fe(s)+ O2(g)
O2(g) FeO(s)
△H=-272 kJ·mol-1
FeO(s)
△H=-272 kJ·mol-1
C(s)+O2(g) CO2(g) △H=-393.5 kJ·mol-1
CO2(g) △H=-393.5 kJ·mol-1
2C(s)+O2(g) 2CO(g) △H=-221 kJ·mol-1
2CO(g) △H=-221 kJ·mol-1
则高炉炼铁过程中
FeO(s)+CO(g) Fe(s)+CO2(g) △H=
。
Fe(s)+CO2(g) △H=
。
(3)铁红(Fe2O3)是一种红色颜料。将一定量的铁红溶于160mL 5 mol·L-1盐酸中,再加入足量铁粉,待反应结束共收集到气体2.24L(标准状况),经检测溶液中无Fe3+,则参加反应的铁粉的质量为 。
(4)以H2、O2、熔融盐Na2CO3组成燃料电池,采用电解法制备Fe(OH)2,装置如下图所示,其中P端通入CO2。
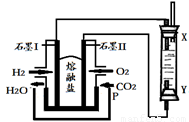
①石墨I电极上的电极反应式为 。
②通电一段时间后,右侧玻璃管中产生大量的白色沉淀,且较长时间不变色。则下列说法中正确的是 (填序号)。
A.X、Y两端都必须用铁作电极
B.可以用NaOH溶液作为电解液
C.阴极发生的反应是:2H2O+ 2e-= H2↑+ 2OH-
D.白色沉淀只能在阳极上产生
③若将所得Fe(OH)2沉淀暴露在空气中,其颜色变化为 ,该反应的化学方程式为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com