
��1����4�֣���¯���������з�������Ҫ��ӦΪ��1/3Fe2O3(s)+CO(g)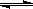 2/3Fe (s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����¡���
2/3Fe (s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����¡���
�ٸ÷�Ӧ�ġ�H_____0(�>������<����=��)��
����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0 mol����Ӧ����l0 min��ﵽƽ�⡣��CO��ƽ��ת����= ________��
��2����3�֣������£�HR���ᣩ��ҺpH=3��MOH�������ҺpH=11�����ߵ������Ϻ���Һ�Լ��ԡ�������Һ�бض���һ�������ܷ���ˮ�⣬��ˮ�ⷴӦ�����ӷ���ʽ
___________________________________________��
��3����3�֣�25��ʱ��pH=0��HCl��0.1mol/L��HCl��0.01mol/L��NaOH��pH=14��NaOH������Һ����ˮ���������c��H+��֮��Ϊ ��
��4����3�֣���֪25��ʱ�����볣��Ka(HF)��3.6��10��4����0.1 mol��L��1 HF��Һ��c(H��)�� mol��L��1��
��16�֣�
��1����4�֣�< 60%
��2����3�֣�M++H2O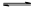 MOH+H+
MOH+H+
��3����3�֣�1��10��100��1
��4����3�֣�6��10��3
��5����3�֣�7
�����������������1�����ɱ������ݿ�֪���¶�Խ��ƽ�ⳣ��ԽС���������¶�ƽ�����淴Ӧ�ƶ�������ӦΪ���ȷ�Ӧ������H��0������ƽ��ʱCO�����ʵ����仯Ϊnmol����
1/3Fe2O3��s��+CO��g��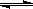 2/3Fe��s��+CO2��g��
2/3Fe��s��+CO2��g��
��ʼ��mol����1 1
�仯��mol����n n
ƽ�⣨mol����1-n 1+n
����(1+n)/(1-n) =4�����n=0.6��
����n��CO��=0.6mol��1mol��100%=60%��
��2����������Ĺ��ɡ�˭��˭ˮ�⣬˭ǿ��˭�ԡ���MR������ǿ���Σ���ˮ�ⷴӦ�����ӷ���ʽΪM++H2O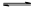 MOH+H+��
MOH+H+��
��3��������Һ����ˮ���������c��H+���ֱ�Ϊ��10-14��10-13��10-12��10-14��֮��Ϊ1��10��100��1��
��4�����볣��Ka(HF)��c(H��)��c(F-)��c(HF) =3.6��10��4��c(HF)=" 0.1" mol��L��1��c(H��)=c(F-)����c(H��)��6��10��3��
��5����3�֣����¶�t ��ʱ��pH=3��ijˮ��Һ��c(OH��)=10��8 mol��L���ڴ��¶���5��10��5mol/LBa��OH��2��Һ��pH= ��
��5�����¶�t ��ʱ�����ӻ�����K= c(OH��)��c(H+)=10-3 (mol��L)��10��8 (mol��L) =10��11 (mol��L)2��5��10��5mol/LBa��OH��2��Һ�У�c(OH��)=10��4 mol��L������K= c(OH��)��c(H+)����c(H��)= 10��7 mol��L��pH=7��
���㣺��ѧƽ�ⳣ�� ת���� �����ˮ�� ˮ�ĵ��� ˮ�����ӻ�����
���������⿼������ۺϵ�֪ʶ����Ŀ�Ѷ��У�ע�����֪ʶ��ѧϰ�����ռ�Ӧ�á�



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 3 |
| 2 |
| 3 |
| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
| 1 |
| 3 |
| 2 |
| 3 |
| �¶�/�� | 1000 | 1150 | 1300 |
| ƽ�ⳣ�� | 4.0 | 3.7 | 3.5 |
| c(CO2) |
| c(CO) |
| c(CO2) |
| c(CO) |
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2013-2014ѧ������������������һ��ѧ��ѧҵ���г�����ۻ�ѧ�Ծ��������棩 ���ͣ������
��Ԫ�ؼ��仯�������������������ϢϢ��أ��Իش��������⣺
��1�����ӹ�ҵ����30����FeCl3��Һ��ʴ���ھ�Ե���ϵ�ͭ��������ӡˢ��·�壬�÷�Ӧ�����ӷ���ʽΪ ��
��2����֪��Fe(s)+ O2(g)
O2(g) FeO(s)
��H=��272 kJ��mol��1
FeO(s)
��H=��272 kJ��mol��1
C(s)+O2(g) CO2(g) ��H=��393.5 kJ��mol��1
CO2(g) ��H=��393.5 kJ��mol��1
2C(s)+O2(g) 2CO(g) ��H=��221 kJ��mol��1
2CO(g) ��H=��221 kJ��mol��1
���¯����������
FeO(s)+CO(g) Fe(s)+CO2(g) ��H=
��
Fe(s)+CO2(g) ��H=
��
��3�����죨Fe2O3����һ�ֺ�ɫ���ϡ���һ��������������160mL 5 mol��L��1�����У��ټ����������ۣ�����Ӧ�������ռ�������2.24L����״�������������Һ����Fe3������μӷ�Ӧ�����۵�����Ϊ ��
��4����H2��O2��������Na2CO3���ȼ�ϵ�أ����õ�ⷨ�Ʊ�Fe(OH)2��װ������ͼ��ʾ������P��ͨ��CO2��
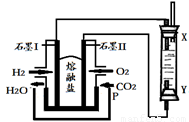
��ʯīI�缫�ϵĵ缫��ӦʽΪ ��
��ͨ��һ��ʱ����Ҳಣ�����в��������İ�ɫ�������ҽϳ�ʱ�䲻��ɫ��������˵������ȷ���� ������ţ���
A��X��Y���˶������������缫
B��������NaOH��Һ��Ϊ���Һ
C�����������ķ�Ӧ�ǣ�2H2O�� 2e��= H2��+ 2OH��
D����ɫ����ֻ���������ϲ���
����������Fe(OH)2������¶�ڿ����У�����ɫ�仯Ϊ ���÷�Ӧ�Ļ�ѧ����ʽΪ ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ��2014������ʡ�߶���ѧ�����п��Ի�ѧ�Ծ����������������棩 ���ͣ������
��1����4�֣���¯���������з�������Ҫ��ӦΪ��1/3Fe2O3(s)+CO(g) 2/3Fe (s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����¡���
2/3Fe (s)+CO2(g)����֪�÷�Ӧ�ڲ�ͬ�¶��µ�ƽ�ⳣ�����¡���

�ٸ÷�Ӧ�ġ�H_____0(�>������<����=��)��
����һ���ݻ�Ϊ10L���ܱ������У�1000��ʱ����Fe��Fe2O3��CO��CO2��1.0 mol����Ӧ����l0 min��ﵽƽ�⡣��CO��ƽ��ת����= ________��
��2����3�֣������£�HR���ᣩ��ҺpH=3��MOH�������ҺpH=11�����ߵ������Ϻ���Һ�Լ��ԡ�������Һ�бض���һ�������ܷ���ˮ�⣬��ˮ�ⷴӦ�����ӷ���ʽ
___________________________________________��
��3����3�֣�25��ʱ��pH=0��HCl��0.1mol/L��HCl��0.01mol/L��NaOH��pH=14��NaOH������Һ����ˮ���������c��H+��֮��Ϊ ��
��4����3�֣���֪25��ʱ�����볣��Ka(HF)��3.6��10��4����0.1 mol��L��1 HF��Һ��c(H��)�� mol��L��1��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com