
【题目】有A、B、C、D四种元素,其中A元素和B元素的原子都有1个未成对电子,A+比B-少一个电子层,B原子得一个电子填入3p轨道后,3p轨道已充满;C原子的p轨道中有3个未成对电子,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大;D的最高化合价和最低化合价的代数和为4,其最高价氧化物中含D的质量分数为 40%,且其核内质子数等于中子数。化合物R是由A、D两元素形成的离子化合物,其中A+阳离子与Dn-阴离子数之比为2∶1。请回答下列问题:
(1)B-的电子排布式为______________,在CB3分子中C元素原子的原子轨道发生的是______杂化。
(2)C的氢化物的空间构型为________________,其氢化物在同族元素所形成的氢化物中沸点最高的原因是__________________________________________________________。
(3)B元素的电负性____D元素的电负性(填“>”、“<”或“=”),用一个化学方程式说明B、D两元素形成的单质的氧化性强弱:________________________________。
(4)如图所示是R形成的晶体的晶胞,设晶胞的棱长为a cm。 试计算R晶体的密度为_________________。(阿伏加德罗常数用NA表示)

【答案】 ls22s22p63s23p6或者[Ne]3s23p6 sp3 三角锥形 NH3分子之间存在氢键作用 > Cl2+Na2S=2NaCl+S↓ 312/NAa3
【解析】分析:B原子得一个电子填入3p轨道后,3p轨道已充满,B为Cl元素;B-离子为Cl-离子,A+比B-少一个电子层,A+为Na+离子;C原子的p轨道中有3个未成对电子,C原子的外围电子排布为ns2np3,是第ⅤA族元素,其气态氢化物在水中的溶解度在同族元素所形成的氢化物中最大,所以为N元素;D的最高化合价和最低化合价的代数和为4,为第ⅥA族元素,最高价氧化物中含D的质量分数为40%,可推知D的相对原子质量为32,其核内质子数等于中子数,所以质子数为16,D为S元素,A+是Na+离子,D2-离子是S2-离子,R是由Na+离子与S2-离子以2:1形成的离子化合物,R是硫化钠。
解析:
(1)B离子为Cl离子,电子排布式为ls22s22p63s23p6或者[Ne]3s23p6;CB3分子为NCl3分子,N原子有一对孤对电子,与Cl原子成3个δ键,杂化轨道数为1+3=4,所以为sp3杂化。故答案为:ls22s22p63s23p6或者[Ne]3s23p6;sp3。
(2)C的氢化物为NH3,N原子采取sp3杂化,N原子有一对孤对电子,所以NH3为三角锥形,N原子电负性很强,氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高。故答案为:三角锥形;氨分子间形成氢键,所以氨气比同族其它元素形成的氢化物沸点高。
(4)B为Cl元素,D为S元素,同周期,自左而右,电负性增强,所以电负性Cl>S.利用“在氧化还原反应中,氧化剂氧化性大于氧化产物”原理,一般来说电负性越强,元素的非金属性越强,对应的单质的氧化性越强,如在Cl2+Na2S=2NaCl+S↓反应中,Cl2的氧化性大于O2的氧化性。故答案为:>;Cl2+Na2S=2NaCl+S↓
(5)A+是Na+离子,D2离子是S2离子,根据均摊法计算,晶胞含有S2离子个数8×1/8+6×1/2=4,含有A+是Na+离子8个,即一个晶胞含有4个硫化钠分子,所以密度为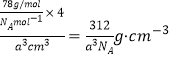 ,故答案为:
,故答案为:![]() 。
。


科目:高中化学 来源: 题型:
【题目】锗(Ge)是典型的半导体元素,在电子、材料等领域应用广泛。回答下列问题:
(1)基态Ge原子的核外电子排布式为[Ar]________,有________个未成对电子。
(2)Ge与C是同族元素,C原子之间可以形成双键、叁键,但Ge原子之间难以形成双键或叁键。从原子结构角度分析,原因是_______________________________。
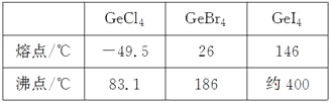
(3)比较下列锗卤化物的熔点和沸点,分析其变化规律及原因_____________________。
(4)光催化还原CO2制备CH4反应中,带状纳米Zn2GeO4是该反应的良好催化剂。Zn、Ge、O电负性由大至小的顺序是________________。
(5)Ge单晶具有金刚石型结构,其中Ge原子的杂化方式为____________,微粒之间存在的作用力是________________。
(6)晶胞有两个基本要素:
①原子坐标参数,表示晶胞内部各原子的相对位置,下图为Ge单晶的晶胞,其中原子坐标参数A为(0,0,0);B为(1/2,0,1/2);C为(1/2,1/2,0)。则D原子的坐标参数为________。
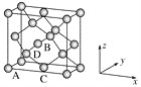
②晶胞参数,描述晶胞的大小和形状,已知Ge单晶的晶胞参数a=565.76 pm,其密度为________g·cm-3(列出计算式即可)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以冶铝的废弃物铝灰为原料制取超细α氧化铝,既降低环境污染又可提高铝资源的利用率。已知铝灰的主要成分为Al2O3(含少量杂质SiO2、FeO、Fe2O3),其制备实验流程如下图:
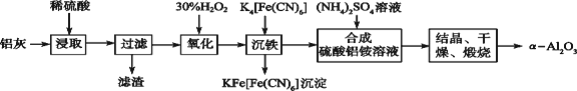
(1)写出铝灰与氢氧化钠溶液反应涉及的化学方程式:_______________________。
(2)加30%H2O2溶液发生的离子反应方程式为______________________________。
(3)煅烧硫酸铝铵晶体,发生的主要反应为:4[NH4Al(SO4)2·12H2O]![]() 2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
2Al2O3+2NH3↑+N2↑+5SO3↑+3SO2↑+53H2O,将产生的气体通过下图所示的装置。
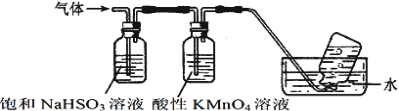
集气瓶中收集到的气体是_______(填化学式)。
②酸性KMnO4溶液紫色变浅_______(填“能”或“不能”)说明煅烧硫酸铝铵晶体产物中含有SO2气体?理由:______。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铁单质及其化合物在生活、生产中有广泛应用。请回答下列问题:
(1)黄铁矿(FeS2)是生产硫酸和冶炼钢铁的重要原料,其中发生的一个反应为3FeS2+8O2![]() 6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移_______mol电子。
6SO2+Fe3O4,若有3 mol FeS2参加反应,则转移_______mol电子。
(2)氯化铁溶液常用作印刷电路铜板的腐蚀剂,反应的离子方程式为________________。从腐蚀废液中回收金属铜还需要的试剂是__________。
(3)与明矾相似,硫酸铁也可用于净水,其作用原理是____________________(用离子方程式表示);在使用时发现硫酸铁并不能使酸性废水中悬浮物沉降除去,其原因是_______________。
(4)铁红是一种红色颜料,其主要成分是Fe2O3。将一定量的铁红溶于160 mL 5 mol·L-1盐酸中,再加入一定量铁粉恰好溶解,收集到2.24 L氢气(标准状况),经检测,溶液中无Fe3+,则参加反应的铁粉的质量为_____。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】同温同压下,等质量的SO2和CO2相比较,下列叙述中正确的是
A. 物质的量之比为1:1B. 体积之比为11:16
C. 氧原子数之比为1:1D. 密度之比为11:16
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关实验原理或实验操作正确的是( )
A.利用丁达尔效应鉴别FeCl3溶液和Fe(OH)3胶体
B.只能利用焰色反应可鉴别KCl溶液和Na2SO4溶液
C.用润湿的pH试纸测量某溶液的pH
D.实验室用NaOH溶液除去CO2中的少量HCl气体
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某研究性学习小组设计实验验证以下规律:元素的非金属性越强,对应的最高价氧化物的水化物酸性就越强。该小组设计了如图装置进行实验。拟比较C、Si、S三种元素的非金属性。
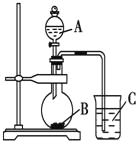
(1)推测三种元素对应的最高价氧化物的水化物酸性由强到弱的顺序是_________________(填化学式)。
(2)若B、C均为正盐,且焰色反应均为黄色。A、B、C的化学式依次为_________、__________、_________(A、C填溶质的化学式)。
(3)烧瓶中的实验现象为________________________________。
(4)固体B也可以用B的溶液代替。实验室配制0.1mol/L的B的溶液450mL,需要用托盘天平称取B_____g。
(5)有同学认为,将A中物质换为浓硝酸,其余试剂不变。则可以验证N、C、Si三元素的非金属性强弱。你认为,该同学的观点___________(选填“正确”“错误”)。理由是__________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列有关说法中不正确的是( )
A.工业上可利用海水制取镁
B.从海产品(如海带等)中提取碘是工业上获取碘的重要途径
C.工业上可通过铝土矿获得铝
D.工业上用CO氧化赤铁矿(含Fe2O3)获得铁
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com