
【题目】常温下,将一定浓度的NaOH溶液逐滴加入到20.00mL一定物质的量浓度的硫酸中,反应过程中溶液pH和所加NaOH溶液的体积关系如下图所示。

(1)由图可知,硫酸的物质的量浓度为_____________;
(2)计算NaOH溶液的物质的量浓度;
(3)计算加入10mLNaOH溶液时,溶液的pH
(已知 lg2=0.3;混合后溶液的体积按混合前两种溶液的体积之和计算)。
 学而优衔接教材南京大学出版社系列答案
学而优衔接教材南京大学出版社系列答案 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】工业上可利用右图所示电解装置吸收和转化SO2 (A,B均为惰性电极)。下列说法正确的是

A. B电极为电解池的阴极
B. B极区吸收5mo1 SO2,则A极区生成2.5 mo1 S2O42-
C. B极区电解液为稀硫酸,电解一段时间后硫酸浓度增大
D. A电极的电极反应为:2SO32--2e-+4H+=S2O42- + 2H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于糖类的说法正确的是( )
A. 所有糖类物质都有甜味,但不一定都溶于水
B. 葡萄糖和果糖性质不同,但分子式相同
C. 摄入人体的纤维素在酶的作用下能水解为葡萄糖
D. 用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有机物AM有如图所示转化关系,A与F分子中所含碳原子数相同,且均能与 NaHCO3溶液反应;F的分子式为C9H10O2,且不能使溴的CCl4溶液褪色;D能发生银镜反应;M与NaOH溶液反应后的产物,其一氯代物只有一种。

请回答:
(1)B、F的结构简式分别为____________、____________。
(2)反应①⑦中,属于消去反应的是________ (填反应序号)
(3)D发生银镜反应的化学方程为_________________________________________;
反应⑦的化学方程为__________________________________________________。
(4)A的相对分子质量在180260之间,从以上转化中不能确认A中的某一官能团,确定该官能团的实验步骤和现象为________________________________________。
(5)符合下列条件的F的同分异构体共有________种。
a.能发生银镜反应
b.能与FeCl3溶液发生显色反应
c.核磁共振氢谱上有四个峰,其峰面积之比为1:1:2:6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】节日焰火表演,精彩纷呈,让人惊叹不已。下列关于焰色反应的说法正确的是( )
A. 焰色反应是金属化合物的性质
B. NaCl与Na2CO3灼烧时火焰颜色相同
C. 焰色反应均应透过蓝色钴玻璃观察
D. 所有金属及其化合物灼烧时火焰均有颜色
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】短周期元素W、X、Y、Z的原子序数依次增加。m、p、r是由这些元素组成的二元化合物。n是元素Z的单质。通常为黄绿色气体,q的水溶液具有漂白性。0.01mol/Lr溶液的![]() 为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是
为2,s通常是难溶于水的混合物。上述物质的转化关系如图所示。下列说法正确的是

A. 原子半径的大小W<X<Y
B. 元素的非金属性Z>X>Y
C. ![]() 的氢化物常温常压下为液态
的氢化物常温常压下为液态
D. ![]() 的最高价氧化物的水化物为强酸
的最高价氧化物的水化物为强酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述正确的是( )
A.纯碱和烧碱都属于碱
B.凡是能电离出H+的化合物都叫做酸
C.铝片在空气中能剧烈燃烧并放出大量的热
D.NH3的水溶液可以导电,但NH3属于非电解质
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】资料显示“O2的氧化性随溶液pH的增大逐渐减弱”。某兴趣小组探究不同条件下KI与O2的反应.实验如下。
装置 | 烧杯中的液体 | 现象(5分钟后) |
| ①2 mL1 mol/LKI溶液+5滴淀粉 | 无明显变化 |
②2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L HCl | 溶液变蓝 | |
③2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L KCl | 无明显变化 | |
④2 mL1 mol/LKI溶液+5滴淀粉+2 mL0.2 mol/L CH3COOH | 溶液变蓝,颜色较②浅 |
(1)实验②中生成I2的离子方程式是___________。
(2)实验③的目的是_________________________________________________________________。
(3)实验④比②溶液颜色浅的原因是________。
(4)为进一步探究KI与O2的反应,用上表中的装置继续进行实验:
烧杯中的液体 | 现象(5小时后) |
⑤2 mLpH=8.5混有KOH的1mol/L KI溶液+5滴淀粉 | 溶液才略变蓝 |
⑥2 mLpH=10混有KOH的1mol/L KI溶液+5滴淀粉 | 无明显变化 |
I.对于实验⑥的现象.甲同学提出猜想“pH=10时O2不能氧化I-”,设计了下列装置进行实验,验证猜想。
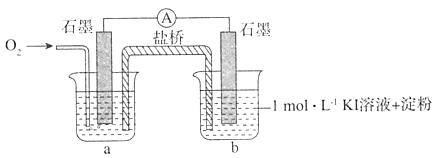
i.烧杯a中的溶液为____。
ii.实验结果表明,此猜想不成立。支持该结论的实验现象是:通入O2后,_______。
Ⅱ.乙同学向pH=10的KOH溶液(含淀粉)中滴加碘水,溶液先变蓝后迅速褪色.经检测褪色后的溶液中含有IO3-,褪色的原因是(用离子方程式表示)____________。
(5)该小组同学对实验过程进行了整体反思.推测实验①的现象产生的原因可能是______;实验⑥的现象产生的原因可能是_______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com