
【题目】烃A中碳、氢两种元素的质量比是24:5,G具有浓郁的香味。它们之间的转化关系如下(含有相同官能团的有机物通常具有相似的化学性质):
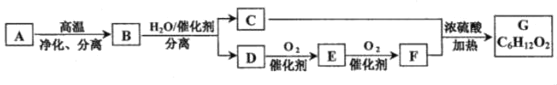
请回答:
(1)化合物B所含的官能团的名称是___。
(2)D的结构简式是___。
(3)C+F→G的化学方程式是___。
(4)下列说法正确的是___。
A.在工业上,A→B的过程可以获得汽油等轻质油
B.有机物C与D都能与金属钠反应,C经氧化也可得到F
C.可以用碳酸钠溶液鉴别E、F、G
D.等质量的E、G混合物,无论以何比例混合,完全燃烧耗氧量相同
【答案】碳碳双键 CH3CH2CH2OH H3CH2COOH+CH3CHOHCH3![]() CH3CH2COOCH(CH3)2+H2O CD
CH3CH2COOCH(CH3)2+H2O CD
【解析】
烃A中碳、氢两种元素的质量比是24:5,则N(C):N(H)=![]() ,应为C4H10,由生成物G的分子式可知C为CH3CHOHCH3,D为CH3CH2CH2OH,E为CH3CH2CHO,F为CH3CH2COOH,B为CH3CH=CH2,生成G为CH3CH2COOCH(CH3)2,以此解答该题。
,应为C4H10,由生成物G的分子式可知C为CH3CHOHCH3,D为CH3CH2CH2OH,E为CH3CH2CHO,F为CH3CH2COOH,B为CH3CH=CH2,生成G为CH3CH2COOCH(CH3)2,以此解答该题。
(1)B为CH3CH=CH2,含有的官能团为碳碳双键,故答案为:碳碳双键;
(2)D为CH3CH2CH2OH,故答案为:CH3CH2CH2OH;
(3) C+F→G的化学方程式是CH3CH2COOH+CH3CHOHCH3![]() CH3CH2COOCH(CH3)2+H2O,
CH3CH2COOCH(CH3)2+H2O,
故答案为:CH3CH2COOH+CH3CHOHCH3![]() CH3CH2COOCH(CH3)2+H2O;
CH3CH2COOCH(CH3)2+H2O;
(4)A.在工业上,A→B的过程为裂解,可获得乙烯等烯烃,而裂化可以获得汽油等轻质油,故A错误;
B.有机物C与D都能与金属钠反应,C经氧化生成丙酮,故B错误;
C.醛可溶于水,酸与碳酸钠反应,酯类不溶于水,则可以用碳酸钠溶液鉴别E、F、G,故C正确;
D.E、G的最简式相同,则等质量的E、G混合物,无论以何比例混合,完全燃烧耗氧量相同,故D正确;故答案为:CD。


 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有离子:K+、Na+、Fe2+、Fe3+、SO32-、SO42-,且溶液中各离子的物质的量相等,将此溶液分为两份,一份加高锰酸钾溶液,现象为紫色褪去,另一份加氯化钡溶液,产生了难溶于水的沉淀。下列说法正确的是( )
A.若溶液中含有硫酸根,则可能含有K+
B.若溶液中含有亚硫酸根,则一定含有K+
C.溶液中可能含有Fe3+
D.溶液中一定含有Fe2+和SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】举世闻名的侯氏制碱法的工艺流程如下图所示,下列说法正确的是( )

A.往母液中加入食盐的主要目的是使![]() 更多的析出
更多的析出
B.从母液中经过循环Ⅰ进入沉淀池的主要是![]() 、
、![]() 和氨水
和氨水
C.沉淀池中反应的化学方程式:![]()
D.设计循环Ⅱ的目的是使原料氯化钠的利用率大大提升
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Bodensteins研究了下列反应:2HI(g)![]() H2(g)+I2(g)
H2(g)+I2(g)![]() 。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
。在716K时,气体混合物中碘化氢的物质的量分数x(HI)与反应时间t的关系如下表:
t/min | 0 | 20 | 40 | 60 | 80 | 120 |
x(HI) | 1 | 0.91 | 0.85 | 0.815 | 0.795 | 0.784 |
x(HI) | 0 | 0.60 | 0.73 | 0.773 | 0.780 | 0.784 |
由上述实验数据计算得到v正~x(HI)和v逆~x(H2)的关系可用如图表示。当升高温度,再次达到平衡时,v正 v逆可能落在A、B、C、D、E哪些点。
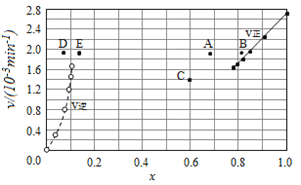
A. A D B. B D C. B E D. A E
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氮及其化合物在工农业生产和生命活动中起着重要作用。
(1)氨气是一种重要的化工原料,氨态氮肥是常用的肥料。
哈伯法合成氨技术的相关反应为:N2(g)+3H2(g)![]() 2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
2NH3(g) △H=-93kJ/mol,实际生产中,常用工艺条件:Fe作催化剂,控制温度773K、压强3.0×107Pa,原料气中N2和H2物质的量之比为1:2.8。
①合成氨技术是氮的固定的一种,属于______(选填“大气固氮”、“生物固氮”“人工固氮”)。
②合成氨反应常用铁触媒催化剂,下列关于催化剂的说法不正确的是_________。
A.可以加快反应速率 B.可以改变反应热
C.可以减少反应中的能耗 D.可以增加活化分子的数目
③关于合成氨工艺的下列理解,正确的是_________。
A.原料气中N2过量,是因N2相对易得,适度过量有利于提高H2的转化率
B.控制温度(773K)远高于室温,是为了保证尽可能高的平衡转化率和快的反应速率
C.当温度、压强一定时,在原料气(N2和H2的比例不变)中添加少量惰性气体,有利于提高平衡转化率
D.分离空气可得N2,通过天然气和水蒸气转化可得H2,原料气须经过净化处理,以防止催化剂中毒和安全事故发生
(2)肼(N2H4)是氮的氢化物之一,其制备方法可用次氯酸钠氧化过量的氨气。
①次氯酸钠溶液显碱性,表示原理的离子方程式是_________________________。
②常温下,该水解反应的平衡常数为K=1.0×10-6mol/L,则1.0mol/LNaClO溶液的pH=____。
③肼与N2O4氧化反应生成N2和水蒸气。
已知:N2(g)+2O2(g)=N2O4(l) △H=-19.5kJ/mol
N2H4(l)+O2(g)=N2(g)+2H2O(g) △H=-534.2kJ/mol
请写出肼和N2O4反应的热化学反应方程式_________________________________。
(3)在NH4HCO3溶液中,反应NH4++HCO3-+H2O![]() NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
NH3·H2O+H2CO3的平衡常数K=_____。(已知常温下NH3·H2O的电离平衡常数Kb=2×10-5,H2CO3的电离平衡常数Ka1=4×10-7)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知某物质X能发生如下转化:
![]()
下列有关上述转化关系中物质及其反应的叙述错误的是( )
A.若X为![]() 或
或![]() ,则A为硝酸
,则A为硝酸
B.若X为![]() 或
或![]() ,则A为硫酸
,则A为硫酸
C.若X为非金属单质或非金属氢化物,则A不一定能与金属铜反应生成Y
D.反应①和②一定为氧化还原反应,反应③一定为非氧化还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定条件下,下列反应中水蒸气含量随反应时间的变化趋势符合下图的是( )

A. CO2(g)+H2(g) ![]() CO(g)+H2O(g) ΔH>0
CO(g)+H2O(g) ΔH>0
B. CH3CH2OH(g )![]() CH2===CH2(g)+H2O(g) ΔH>0
CH2===CH2(g)+H2O(g) ΔH>0
C. 2C6H5CH2CH3(g)+O2(g) ![]() 2C6H5CH===CH2(g)+2H2O(g) ΔH<0
2C6H5CH===CH2(g)+2H2O(g) ΔH<0
D. CO2(g)+2NH3(g) ![]() CO(NH2)2(s)+H2O(g) ΔH<0
CO(NH2)2(s)+H2O(g) ΔH<0
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在100℃时,把0.5molN2O4通入体积为5L的真空密闭容器中,立即出现红棕色。反应进行到2s时,NO2的浓度为0.02mol·L-1。在60s时,体系已达平衡,此时容器内压强为开始时的1.6 倍。下列说法正确的是( )
A.前2s以N2O4的浓度变化表示的平均反应速率为0.01mol·L-1·s-1
B.在2s时体系内的压强为开始时的1.2倍
C.在平衡时体系内N2O4的物质的量为0.2mol
D.平衡时,N2O4的转化率为40%
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】对于工业合成氨反应N2+3H22NH3+Q(Q>0),下列判断正确的是( )
A.3体积![]() 和足量
和足量![]() 反应,必定生成2体积
反应,必定生成2体积![]()
B.使用合适的催化剂,可以提高提高原料的利用率
C.![]() 左右比室温更有利于向合成氨的方向进行
左右比室温更有利于向合成氨的方向进行
D.及时使氨液化、分离的主要目的是提高![]() 和
和![]() 的利用率
的利用率
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com