
| A. | ①② | B. | ②⑤ | C. | ③⑤ | D. | ④⑥ |
分析 ①生成物质量增大小于混合物总质量增大,生成物的质量分数可能降低;
②增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低;
③平衡向正反应移动,生成物的物质的量一定增加;
④如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大;
⑤平衡向正反应移动,正反应速率一定大于逆反应速率;
⑥加入催化剂,正逆反应速率同等程度增大,平衡不移动
解答 解:①总质量不变,向正反应移动,生成物的质量分数一定增大,若生成物质量增大小于混合物总质量增大,生成物的质量分数可能降低,故①错误;
②降低生成物的浓度,平衡向正反应方向移动,反应物的转化率一定增大,但增大某一反应的浓度,平衡向正反应移动,其它反应物的转化率增大,自身转化率降低,故②错误;
③平衡向正反应移动,生成物的物质的量一定增加,故③正确;
④如增大反应物的浓度,平衡向正方向移动,达到平衡时,反应物的浓度比改变条件前大,故④错误;
⑤平衡向正反应移动,正反应速率一定大于逆反应速率,故⑤正确;
⑥加入催化剂,正逆反应速率同等程度增大,平衡不移动,故⑥错误;
综上所述③⑤正确,
故选C.
点评 本题考查化学平衡的影响因素,题目难度中等,注意影响化学平衡移动的因素,解答时注意从勒沙特列原理的角度分析.


科目:高中化学 来源: 题型:选择题
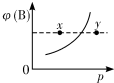 现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )
现有mA(s)+nB(g)?qC(g)△H<0的可逆反应,在一定温度下达平衡时,B的体积分数ψ(B)和压强p的关系如图所示,则下列有关该反应的描述正确的是( )| A. | m+n<q | B. | n>q | ||
| C. | x点的混合物中v(正)<v(逆) | D. | x点比y点的正反应速率小 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用Pt电极电解少量的MgC12溶液:2H2O+2Cl- $\frac{\underline{\;通电\;}}{\;}$H2↑+C12↑+2OH- | |
| B. | 明矾溶液中加入Ba(OH)2溶液至生成的沉淀的质量最多:Al3++2SO42-+2Ba2++4OH-═AlO2-+2BaSO4↓+2H2O | |
| C. | 向含有4 mol FeBr2的溶液中通入3 mol Cl2充分反应:2Fe2++4Br-+3Cl2═4Fe3++6Cl-+Br2 | |
| D. | 碳酸钙溶于醋酸中:CaCO3+2H+═Ca2++CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 采取低碳、节俭的生活方式,深入农村和社区宣传环保知识 | |
| B. | 经常使用一次性筷子、纸杯、塑料袋等,按照规定对生活废弃物逛行分类放量 | |
| C. | 热纯碱可以去油污,明矾可以净化水,漂白粉可用于漂白织物 | |
| D. | 煮沸自来水可除去其中的Ca(HCO3)2,食醋可以除水垢 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题

查看答案和解析>>
科目:高中化学 来源: 题型:填空题

查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com