
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于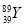 的说法不正确的是( )
的说法不正确的是( )
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数是39
D.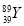 和
和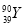 是两种不同的核素
是两种不同的核素
科目:高中化学 来源:2014年高考化学苏教版总复习 6-3 原电池金属的腐蚀及防护练习卷(解析版) 题型:填空题
如图甲、乙是电化学实验装置。
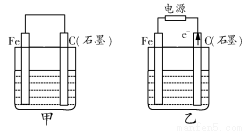
(1)若甲、乙两烧杯中均盛有饱和NaCl溶液。
①甲中石墨棒上的电极反应式为__________________________________;
②乙中总反应的离子方程式为____________________________________;
③将湿润的淀粉-KI试纸放在乙烧杯上方,发现试纸先变蓝后褪色,这是因为过量的Cl2氧化了生成的I2。
若反应中Cl2和I2的物质的量之比为5:1,且生成两种酸,该反应的化学方程式为________________________________。
(2)若甲、乙两烧杯中均盛有CuSO4溶液。
①甲中铁棒上的电极反应式为____________________________________;
②如果起始时乙中盛有200 mL pH=5的CuSO4溶液(25℃),一段时间后溶液的pH变为1,若要使溶液恢复到电解前的状态,可向溶液中加入___________(填写物质的化学式)________g。
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 6-1 化学反应中的热效应练习卷(解析版) 题型:选择题
H2O(g)―→H2O(l)是一个放热过程,但不是化学反应,A错。HI+H2SO4(aq)=ZnSO4(aq)+H2(g) ΔH<0,则下列关于该反应的叙述不正确的是( )
A.该反应中旧键断裂需吸收能量,新键形成需放出能量,所以总能量不变
B.上述热化学方程式中的ΔH的值与反应物的用量无关
C.该反应的化学能可以转化为电能
D.反应物的总能量高于生成物的总能量
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-2 元素周期律 元素周期表练习卷(解析版) 题型:选择题
如图为元素F、S、Cl在周期表中的位置,关于F、S、Cl的说法正确的是( )

A.非金属性:F>S>Cl
B.原子半径:Cl>S>F
C.稳定性:HF>HCl>H2S
D.离子半径:Cl->S2->F-
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
下列叙述正确的是( )
A.乙酸与丙二酸互为同系物
B.不同元素的原子构成的分子只含极性共价键
C. 和
和 是中子数不同质子数相同的同种核素
是中子数不同质子数相同的同种核素
D.短周期第ⅣA与ⅦA族元素的原子间构成的分子,均满足原子最外层8电子结构
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
简单原子的原子结构可用下图形象地表示。其中●表示质子或电子,○表示中子,则下列有关①②③的叙述正确的组合是 ( )
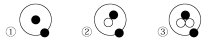
a.①②③互为同位素
b.①②③互为同素异形体
c.①②③是三种化学性质不同的粒子
d.①②③具有相同的质量数
e.①②③具有相同的质量
f.①②③是三种不同的原子
A.a、f B.b、c C.d、e D.e、f
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-3 含硅矿物与信息材料练习卷(解析版) 题型:选择题
我国成功地发射了嫦娥一号探测卫星,对月球土壤中14种元素的分布及含量进行探测等。月球的矿产资源极为丰富,仅月球表层5 cm厚的沙土中就含铁单质上亿吨,月球上的主要矿物有辉石[CaMgSi2O6]、斜长石[KAlSi3O8]和橄榄石[(MgFe)2SiO6]等,下列说法或分析不正确的是( )
A.辉石、斜长石及橄榄石均属于硅酸盐
B.斜长石的氧化物形式可表示为:K2O·Al2O3·6SiO2
C.橄榄石中铁为+2价
D.月球上有游离态铁是因为月球上铁的活动性比地球上铁的活动性弱
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-2 铁、铜的获取和应用练习卷(解析版) 题型:选择题
将1.12 g铁粉加入25 mL 2 mol·L-1的氯化铁溶液中,充分反应后,其结果是( )
A.铁有剩余,溶液呈浅绿色,Cl-浓度基本不变
B.往溶液中滴入无色KSCN溶液,显黄色
C.Fe2+和Fe3+的物质的量之比为6:1
D.氧化产物与还原产物的物质的量之比为2:5
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:填空题
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com