
亚氯酸钠(NaClO2)是一种重要的含氯消毒剂,主要用于水的消毒以及纺织品的漂白。过氧化氢法生产亚氯酸钠的操作步骤如下:
①将氯酸钠(NaClO3)和盐酸加入到ClO2发生器中;
②将产生的ClO2气体在稳定装置中用水吸收后,再加入NaOH和双氧水;
③在固体分离装置中进行分离,得到亚氯酸钠。
已知NaClO2的溶解度随温度升高而增大,适当条件下可结晶析出NaClO2·3H2O,且NaClO2在碱性条件下稳定性较高。试回答下列问题:
(1)在ClO2发生器中同时有氯气产生,则在ClO2发生器中发生反应的化学方程式为 。
(2)在ClO2稳定装置中,H2O2作 (选填序号)。
A.氧化剂
B.还原剂
C.既作氧化剂又作还原剂
D.既不作氧化剂也不作还原剂
(3)在实验室模拟“固体分离装置”中的技术,必须进行的实验操作是 (按实验先后顺序填写操作代号)。
A.过滤 B.加热 C.蒸发
D.分液 E.蒸馏 F.冷却
(4)经查阅资料可知,当pH≤2.0时,ClO2-能被I-完全还原成Cl-,欲测定成品中NaClO2的含量,现进行以下操作:
步骤Ⅰ | 称取样品Wg于锥形瓶中,并调节pH≤2.0 |
步骤Ⅱ | 向锥形瓶中加入足量的KI晶体,并加入少量的指示剂 |
步骤Ⅲ | 用c mol·L-1的Na2S2O3溶液滴定,生成I-和S4O62- |
①步骤Ⅱ中发生反应的离子方程式是 ,步骤Ⅲ中达到滴定终点时的现象是 。
②若上述滴定操作中用去了V mL Na2S2O3溶液,则样品中NaClO2的质量分数为 (用字母表示)。
(1)2NaClO3+4HCl=2ClO2↑+Cl2↑+2NaCl+2H2O
(2)B (3)BCFA
(4)①ClO2-+4H++4I-=2I2+Cl-+2H2O 滴入最后一滴Na2S2O3溶液时,溶液蓝色褪去且半分钟内不恢复 ②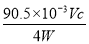 ×100%
×100%
【解析】(1)由题意知,反应物为NaClO3和盐酸,生成物有ClO2、Cl2,可推知还有NaCl和H2O。(2)因为最终产物为NaClO2,由ClO2得到NaClO2,氯元素的化合价降低,故H2O2作还原剂。(3)要将NaClO2从溶液中分离出来,应该采取加热蒸发,冷却结晶的方法,析出固体后再进行过滤。(4)I2遇淀粉变蓝,故需要用淀粉作指示剂。当到达终点时,I2完全被还原,溶液的蓝色褪去。由步骤Ⅲ知:I2+2S2O32-=2I-+S4O62-,故有NaClO2~2I2~4S2O32-,样品中NaClO2的质量分数为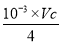 ×90.5÷W×100%=
×90.5÷W×100%=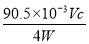 ×100%。
×100%。


 互动英语系列答案
互动英语系列答案 名牌学校分层周周测系列答案
名牌学校分层周周测系列答案科目:高中化学 来源:2014年高考化学苏教版总复习 5-1 人类对原子结构的认识练习卷(解析版) 题型:选择题
YBa2Cu8Ox(Y为元素钇)是磁悬浮列车中的重要超导材料,关于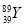 的说法不正确的是( )
的说法不正确的是( )
A.属于金属元素
B.质子数与中子数之差为50
C.原子的核外电子数是39
D.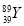 和
和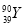 是两种不同的核素
是两种不同的核素
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 3-1 从铝土矿到铝合金练习卷(解析版) 题型:实验题
某探究小组用金属铝分别与稀盐酸或稀硫酸反应的方法研究金属与不同酸反应的差异及影响反应速度的因素。
实验药品:2.0 mol/L盐酸、4.0 mol/L盐酸、2.0 mol/L硫酸、4.0 mol/L硫酸、相同大小的铝片和铝粉(金属表面氧化膜都已除去);每次实验各种酸的用量均为50.0 mL,金属用量均为9.0 g。
Ⅰ.甲同学用铝片分别和稀盐酸、稀硫酸反应,实验及其现象如下:
反应进程 (分钟) | 1 | 2 | 5 | 15 | 20 |
4.0 mol/L 盐酸 | 少量气泡 | 较多气泡 | 大量气泡 | 反应剧烈 | 铝片耗尽 |
2.0 mol/L 硫酸 | 无明显现象 | 极少量 气泡 | 少量气泡 | ||
4.0 mol/L 硫酸 | 无明显现象 | 少量气泡 | 有比较连续的气泡 | ||
请回答下列问题:
(1)写出铝与盐酸反应的离子方程式: 。
(2)反应在1~15min内,铝与盐酸的反应速率逐渐增大,其原因是 。
(3)根据以上探究“铝与稀盐酸和稀硫酸的反应速率存在差异的原因”,你能对原因作出哪些假设或猜想: (写出一种即可)。
Ⅱ.乙同学设计了如下影响反应速率因素的实验。请你根据实验目的帮助该同学完成以下实验设计表:
实验目的 | 实验 编号 | 温度 /℃ | 金属铝的 形态 | 盐酸浓度 /mol·L-1 |
1.实验①和②探究盐酸浓度对该反应速率的影响; 2.实验①和③探究温度对该反应速率的影响; 3.实验①和④探究金属规格(铝片、 铝粉)对该反应速率的影响 | ① | 25 | 铝片 | 4.0 |
② |
|
|
| |
③ |
|
|
| |
④ |
|
|
|
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
将含有O2和CH4的混合气体置于盛有23.4 g Na2O2的密闭容器中,用电火花点燃,反应结束后,容器内的压强为零(150℃),将残留物溶于水中,无气体生成。下列叙述中正确的是( )
①混合气体中O2和CH4的体积比为2:1
②残留物只有Na2CO3
③混合气体中O2与CH4的物质的量之比为1:2
④残留物只有Na2CO3和NaOH
A.①② B.②③ C.③④ D.①④
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-2 钠、镁及其化合物练习卷(解析版) 题型:选择题
下列各组中的两种物质作用时,反应条件(温度、反应物用量比)改变,不会引起产物的种类改变的是( )
A.Na和O2 B.NaOH和CO2
C.Na2O2和CO2 D.NaHCO3和Ca(OH)2
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:选择题
(CN)2、(OCN)2、(SCN)2等物质的性质与卤素单质相似,而CN-、OCN-、SCN-等离子的性质与卤离子相似,化学上分别将其称之为类卤素和类卤离子,不同的卤素也可以生成卤素互化物,如BrF3。下列关于(CN)2的性质的叙述中,不像卤素的是( )
A.能在空气中燃烧
B.可与银、汞、铅等生成难溶盐
C.在碱溶液中生成CN-和OCN-
D.与Cl2反应生成CNCl
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 2-1 氯、溴、碘及其化合物练习卷(解析版) 题型:选择题
由一种阳离子与两种酸根离子组成的盐称为混盐。混盐CaOCl2在酸性条件下可以产生Cl2。下列关于混盐CaOCl2的有关判断正确的是( )
A.该混盐中氯元素的化合价为-1
B.该混盐的水溶液呈中性
C.该混盐与盐酸反应产生1 mol Cl2时转移2 mol电子
D.该混盐具有和漂白粉相似的化学性质
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 13-2 化学资源与材料练习卷(解析版) 题型:选择题
化学与生产、生活、社会密切相关。下列有关说法中不正确的是( )
A.新能源汽车的推广与使用有助于减少光化学烟雾的产生
B.2010年12月10日联合国坎昆气候变化大会,其主要议题是节能减排的低碳经济。低碳经济就是以低能耗、低污染、低排放为基础的经济发展模式
C.华裔科学家高琨在光纤传输信息领域中取得突破性成就,光纤的主要成分是高纯度的单质硅
D.超级病菌NDM-1几乎对所有抗生素都具有抗药性,死亡率很高。为防止超级病菌的感染,要加强环境、个人的卫生和消毒,其中消毒剂常选用含氯消毒剂、双氧水、酒精等适宜的物质
查看答案和解析>>
科目:高中化学 来源:2014年高考化学苏教版总复习 12-2 微粒间作用力与物质性质练习卷(解析版) 题型:选择题
观察下表模型并结合有关信息,判断下列说法中不正确的是( )
| B12结构单元 | SF6分子 | S8分子 | HCN |
结构模型示意图 |
|
|
|
|
备注 | 熔点1873 K | — | 易溶于CS2 | — |
A.单质硼属于原子晶体,每个B12结构单元中含有30个B—B键和20个正三角形
B.SF6是由极性键构成的非极性分子
C.固态硫S8属于原子晶体
D.HCN的结构式为H—C≡N
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com