
����Ŀ����״���£�1.68L��ɫ�Ŀ�ȼ������������������ȫȼ�ա���������ͨ����������ʯ��ˮ�У��õ���ɫ��������Ϊ15g������������ʯ������ȼ�ղ������9.3g��
��1��ȼ�ղ�����ˮ������Ϊ_______ g��
��2����ԭ�����ǵ�һ���壬�������ʽΪ_____________________��
��3����ԭ�����������ֵ����ʵ�������̬����ɵĻ�����д�����ǵķ���ʽ__________________������д�����飩
��4����ԭ�����������ֵ����ʵ�����������ɵĻ�������ֻ��һ����������д�����ǵķ���ʽ____________________________������д�����飩
���𰸡� 2.7 C2H4 CH4�� C3H4 C2H2��C2H6 H2��C4H6 CO��C3H8
������������:�����л���ȼ��ʱ���л����е�̼ȫ��ת��Ϊ������̼��������̼������������������ȫ��Ӧ�����ɲ�����ˮ�İ�ɫ����̼��ƣ���������̼��Ƶ���������ȼ�����ɶ�����̼����������ʯ�Ҽ�������ȼ�����ɵ�ˮ����������ȼ�����ɵĶ�����̼����ˣ����ص�������ȼ�����ɶ�����̼��ˮ�������ܺͣ��Ӷ����ˮ���������������ɶ�����̼��ˮ�������������ȼ����C��HԪ�ص����ʵ������ٸ��������������ʽ���ݴ˽����
(1)��ȼ�ղ����ж�����̼������Ϊx��
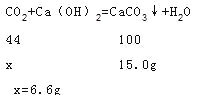
����ʯ�Ҽ�������ȼ�����ɵ�ˮ����������ȼ�����ɵĶ�����̼����ˣ����ص�������ȼ�����ɶ�����̼��ˮ�������ܺͣ�m(CO2)+m(H2O)=9.3g��m(H2O)=9.3g-6.6g=2.7g��
�ʴ�Ϊ��2.7g��
(2)��ɫ��ȼ��������ʵ�����n=![]() = 0.075mol��n(CO2)=
= 0.075mol��n(CO2)=![]() =0.15mol����n(C)=0.15mol��n(H2O)=
=0.15mol����n(C)=0.15mol��n(H2O)=![]() =0.15mol����n(H)=n (H2O)��2=0.3mol����0.075mol�����к���0.15molC��0.3molH������n(����):n(C):n(H)= 0.075mol :0.15mol:0.3mol=1:2:4����1mol�����к���2molC��4molH�����Ը�����ķ���ʽ��C2H4��
=0.15mol����n(H)=n (H2O)��2=0.3mol����0.075mol�����к���0.15molC��0.3molH������n(����):n(C):n(H)= 0.075mol :0.15mol:0.3mol=1:2:4����1mol�����к���2molC��4molH�����Ը�����ķ���ʽ��C2H4��
�ʴ�Ϊ��C2H4��
(3)��Ϊ��һ����ΪC2H4����Ϊ�����ʵ����������������Ļ���������2mol��������У�Ӧ����4molCԭ�ӣ�8molHԭ�ӣ�����������̬�������ǡ�CH4��C3H4����C2H2��C2H6����
�ʴ�Ϊ��CH4�� C3H4�� C2H2��C2H6��
��4����Ϊ��һ����ΪC2H4����Ϊ�����ʵ�������������Ļ����������ֻ��һ��������������2mol�����������Ӧ����4molCԭ�ӡ�8molHԭ���������������������H2��C4H6 ��CO��C3H8����
�ʴ�Ϊ��H2��C4H6 ��CO��C3H8��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij��̬��1����������2���HBr�����ӳɷ�Ӧ�����ò���1mol����6mol Cl2������ȫȡ����Ӧ��������Ľṹ��ʽΪ
A. CH2=CH��CH3 B. CH3��CH=CH��CH3
C. CH2=CH-CH=CH2 D. CH3-C��CH
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���������������������ȷ���ǣ� ��
A.�������
B.�ɱ����������
C.����ʯ��ˮ����������
D.�ྻ�Ŀ�������������
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ijѧϰС����ʵ������������ͼװ��(�г�װ����ȥ)�ⶨij������(FexSy)����ɣ���̽����Ӧ��Dװ��������Һ�к��������ɡ�

ʵ�鲽��:
����I��ͼ����װ�ã����װ�������ԣ�װ��ҩƷ;
����II������Һ©������������������ȼ�ƾ����;
����III��Ӳ�ʲ������й����������ٸı�ʱ��ֹͣ���ȣ���������ƿ�е�ˮһ��ʱ��
����IVʵ�������D��������Һ��ˮ���Ƴ�250mL��Һ;
����
��ش�:
(1)����III�У�ֹͣ���Ⱥ����������ƿ�е�ˮһ��ʱ�䣬��Ŀ��Ϊ___________________��
(2)��C��Dװ��֮�䲻��Ҫ������װ�õ�������_______________________________________��
(3)����IV��������Һʱ����IJ������������������ձ��⣬����_____________________��
(4)ȡ25.00mL����IV ��������Һ������������˫��ˮ���ټ������������ữ��BaCl2��Һ�������ó������ˡ�ϴ�ӡ������������Ϊ4.66g����FexSy�Ļ�ѧʽΪ________________��
(5)��ͬѧ��Ϊ�ɽ�װ��D��Ϊװ��������ʯ�ҵĸ���ܣ�ͨ���ⶨ��Ӧǰ�����ܵ�������������Ԫ�صĺ���������Ϊ�˷���____(��ǡ���)������ԭ��Ϊ_____________________��
(6)��Ӧ��Dװ��������Һ�г�����Na2SO4�⣬�����ܺ���Na2SO3�����õζ����ⶨ��Һ��Na2SO3�ĺ������ɹ�ѡ����Լ�:��0.1000mol/LKMnO4������Һ����0.1000mol/LH2O2��Һ����0.1000mol/LKI������Һ����0.1000 mol/LBaCl2��Һ����0.1000mol/LHCl��Һ��
����ѡ�Լ�Ӧװ��_____(���ʽ����ʽ��) �ζ����С�
�������õķ�Ӧԭ��Ϊ___________________________________(�����ӷ���ʽ��ʾ)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
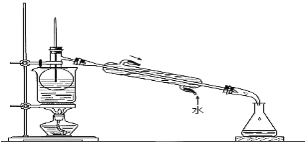
����Ŀ�������ģ������ģ�������������Ԫ��֮һ������ֲ���纣���������к��зḻ�ġ��Ե�������ʽ���ڵĵ�Ԫ�ء���ʵ�����У��Ӻ�������ȡ������̺�ʵ��װ�����£�

��1��ָ��������ȡ��Ĺ������й�ʵ����������ƣ������_________�������______��
��2��д������ܶ�Ӧ��Ӧ�����ӷ���ʽ��______________________________��
��3����ȡ��Ĺ����У��ɹ�ѡ����л��Լ���_______________����������ţ�
A�� �ƾ� B�� ���� C�� ���Ȼ�̼ D�� ��
��4��Ϊ��ʹ������еĵ�����ת��Ϊ����л���Һ������ɲ��������,ʵ���������ձ���������������ƿ���ƾ��ơ����ܡ�Բ����ƿ��ʯ�������Լ���Ҫ�ļг���������Ʒ����ȱ�ٵIJ���������_________________________________________________________��
��5���Ӻ�����л��ܼ�����ȡ��ͻ����л��ܼ�������Ҫ��������ָ����ͼʵ��װ���д��ڵĴ���֮����________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ������ˮ���ij�����װ��ʽ�������й�˵������ȷ���ǣ������� 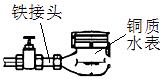
A.������ʴ�����У����Ӵӽ�ͷ����ˮ��
B.��ʴʱ������ͷ�������ǻ�ԭ��Ӧ
C.��ʴʱͭ��ˮ�������ĵ缫��ӦΪ��2H2O+O2+4e���T4OH��
D.��ʴ���̻��漰����Ӧ��4Fe��OH��2+2H2O+O2�T4Fe��OH��3
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������һ��ԭ�ӵ������ܼ���ԭ�ӹ�����Ų�ʱ������Ų�����(����)
A. ns B. np C. (n��1)d D. (n��2)f
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������CaCO3��Ϊ��ҵ����Ҫ����������,�㷺Ӧ���������ϡ�Ϳ�ϡ���ī����ֽ����ҵ��ij��ѧ��ȤС����ʵ��������������װ��ģ�ҵ�Ʊ�����CaCO3.
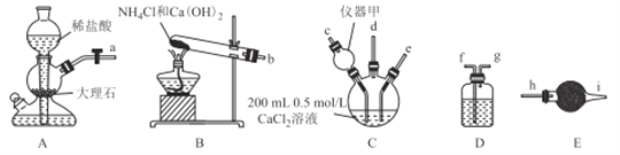
��ش���������:
��1��������������________,�ڸ�ʵ����,��������_____.
��2���������ӿ�����˳������:a![]() ��b
��b![]() ��d
��d![]() ��__________
��__________
��3��װ��D��ѡ����Լ���__________(�����,��ͬ),װ��E��ѡ����Լ���__________
�ٱ���Na2CO3��Һ �ڱ���NaHCO3��Һ ����ˮCaCl2���� �ܼ�ʯ��
��4��װ��C�з�����Ӧ�����ӷ���ʽΪ__________
��5�����������ͨ�룬������ƿ�в�����ɫ������������,��һ��ʱ���,��ɫ��������,����ܵ�ԭ��Ϊ_______(��ϻ�ѧ�������)��
��6��������5g����ʱ,������������������(��״����)�����������Ϊ_________
��7����֪:��������Ksp(CaCO3)=2.8��10-9,Ksp(CaSO3)=1.4��10-7����Ũ��Ϊ1.0mol/L��Na2SO3��Һ�м�������CaCO3,��ʹCaCO3��CaSO3ת��,��û��Һ��c(SO32-)/c(CO32-)��ֵ(x)��ȡֵ��ΧΪ__________��
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com