
(15分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3 。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++ =
= Cl-+
Cl-+ Fe3++
Fe3++ .
.
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O 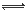 Fe(OH)2++H+——K1
Fe(OH)2++H+——K1
Fe(OH)2++H2O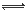 Fe(OH)2++H+——K2
Fe(OH)2++H+——K2
Fe(OH)2++H2O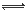 Fe(OH)3+H+——K3
Fe(OH)3+H+——K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
(4)FeCl3也可以用作SO2尾气的吸收剂,原理上与NaOH吸收SO2有何不同______________________
(5)电解时,微粒的放电顺序遵循微粒得失电子能力的强弱,SO32—具有强的还原性。用NaOH吸收烟气中的SO2,将所得的Na2SO3溶液用碳棒进行电解,写出阳极电极反应_____________________________
科目:高中化学 来源:2016届江西省高三上学期第三次月考化学试卷(解析版) 题型:填空题
(12分)X、Y、Z、W是四种短周期元素,X原子M层上的电子数是原子核外电子层数的2倍;Y原子最外层电子数是次外层电子数的2倍;Z元素的单质为双原子分子,Z的氢化物水溶液呈碱性;W元素最高正价是+7价。回答下列问题:
(1)元素X的氢化物的电子 式为___________
式为___________
(2)元素Y的一种中子数为8的同位素可测定文物年代,这种同位素的符号是______________。
(3)元素Z能与氢元素形成+1价阳离子,该阳离子粒子符号是_________________。
(4)元素W的单质与元素X的低价氧化物在水溶液中反应的离子方程式为_____________________。
(5)ZW3常温下呈液态,可与水反应生成一种弱酸和一种弱碱,反应的化学方程式为__ ________ 。
(6)探寻物质的性质差异性是学习的重要方法之一,X、Y、Z、W四种元素的最高价氧化物的水化物中化学性质明显不同于其他三种酸的是_____________(用酸的化学式表示)。
查看答案和解析>>
科目:高中化学 来源:2016届重庆市高三上学期9月月考化学试卷(解析版) 题型:推断题
[化学—选修5:有机化学基础](15分)[此题必选]
带有支链的某烃A的分子式为C6H14,若烃A的一氯取代物只有3种,分别是B、C、D,且有如下的转化。请回答下列问题:
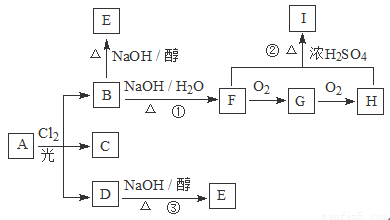
(1)C的名称为________________,G中含有的官能团的名称是______________。
(2)0.1 mol该烃A完全燃烧的产物被碱石灰完全吸收,碱石灰的质量增加__________。
(3)写出下列反应的类型:②_____________;③_____________。
(4)写出D→E的化学方程式_____________________________________________。
(5)H的同分异构体中符合下列条件的共有________种。
① 属于酯类化合物;②水解产物含有相同数目的碳原子。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列推断正确的是
A.SiO2能与NaOH溶液、HF溶液反应,所以SiO2是两性氧化物
B.Na2O、Na2O2组成元素相同,阳离子与阴离子个数比也相同
C.CO、NO、NO2都是大气污染气体,在空气中都能稳定存在
D.新制氯水显酸性,向其中滴加少量紫色石蕊试液,充分振荡后溶液呈红色
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期9月学情调研化学试卷(解析版) 题型:选择题
下列溶液中通入SO2一定不会产生沉淀的沉淀的是
A.Ba(OH)2 B.Ba(NO3)2 C.Na2S D.BaCl2
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:填空题
(7分)丙烷燃烧可以通过以下两种途径:
途径I:C3H8(g) + 5O2(g) == 3CO2(g) +4H2O(l) ΔH=-a kJ·mol-1
途径II:C3H8(g) ==C3H6(g)+ H2(g) ΔH=+b kJ·mol-1
2C3H6(g)+ 9O2(g) == 6CO2(g) +6H2O(l) ΔH=-c kJ·mol-1
2H2(g)+O2 (g) == 2H2O(l) ΔH=-d kJ·mol-1 (abcd均为正值)
请回答下列问题:
(1)判断等量的丙烷通过两种途径完全燃烧放出的热量,途径I放出的热量 ___ ___(填“大于”、“等于”或“小于”)途径II放出的热量。
(2)由于C3H8(g) ==C3H6(g)+ H2(g) 的反应中,反应物具有的总能量 (填“大于”、“等于”或“小于”)生成物具有的总能量,那么在化学反应时。反应物就需要 (填“放出”、或“吸收”)能量才能转化为生成物,因此其反应条件是______________。
(3)b 与a、c、d的数学关系式是 。
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
下列有关能量转换的说法正确的是( )
A. 煤燃烧只是将化学能转化为热能的过程
B. 化石燃料和植物燃料燃烧时放出的能量均来源于太阳能
C. 动物体内葡萄糖被氧化成CO2是热能转变成化学能的过程
D. 植物通过光合作用将CO2转化为葡萄糖是太阳能转变成热能的过程
查看答案和解析>>
科目:高中化学 来源:2016届四川省高三上学期第一次月考化学试卷(解析版) 题型:选择题
设NA为阿伏伽德罗常数的值,下列叙述正确的是
A.标准状态下,33.6L氟化氢中含有氟原子的数目为1.5 NA
B.盛有SO2的密闭容器中含有NA个氧原子,则SO2的物质的量为0.5mol
C.18 g D2O中含有的质子数目为10NA
D. 标准状况下,11.2LSO3所含的分子数为0.5NA
查看答案和解析>>
科目:高中化学 来源:2016届山东省乳山市高三上学期10月月考化学试卷(解析版) 题型:选择题
有一瓶Na2SO3溶液,由于可能已部分氧化,某学生进行如下实验:取少量溶液,滴入Ba(NO3)2溶液产生白色沉淀,再加入过量稀硝酸,充分振荡后仍有白色沉淀,结论正确的是
A.Na2SO3溶液已部分氧化
B.加入Ba(NO3)2溶液后生成的沉淀中一定含有BaSO4
C.加硝酸后的不溶沉淀一定为BaSO4
D.此实验能确定Na2SO3溶液是否部分氧化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com