
 阅读快车系列答案
阅读快车系列答案科目:高中化学 来源:2015-2016学年青海省高二上9月质检化学试卷(解析版) 题型:选择题
把镁条投入到盛有盐酸的敞口容器中,产生H2的速率下列因素中,①盐酸的浓度,②镁条的表面积,③溶液的温度,④氯离子的浓度,影响反应速率的因素是
A.①④ B.③④ C.①②③ D.②③
查看答案和解析>>
科目:高中化学 来源:2016届广东省揭阳市高三上学期第二次月考化学试卷(解析版) 题型:填空题
(15分)
(1)已知下列反应在一定条件下可以发生:
H2O2+2 Fe 2++2 H+===2 Fe3++2 H2O,H2O2+2 Fe3+===2 Fe 2++ O2↑+2 H+。
在以上反应中Fe 2+实际上起着 作用,总反应式为 。
(2)I2也与Fe 2+一样发生上述类似反应,类比(1)在下面横线上填入配平的合适的化学反应方程式:H2O2+I2 ===2HIO , 总反应式为
(3)在H2SO4和KI的混合溶液中加入足量的H2O2,放出大量的无色气体,溶液呈棕色,并可以使淀粉变蓝。有学生认为该反应的离子方程式为:H2O2+2I-===I2+ O2↑+2 H+,这个方程式正确吗? 。(填“正确”或“不正确”),理由是 ;
正确的化学反应方程式为(若是离子反应,写出离子反应式,没有离子反应的,写出化学反应方程式) 。
查看答案和解析>>
科目:高中化学 来源:2016届河北省高三上学期期中测试化学试卷(解析版) 题型:选择题
下列离子组中所给离子在水溶液中能大量共存,且当加入试剂后反应的离子方程式书写完全且正确的是
选项 | 离子组 | 加入试剂 | 发生反应的离子方程式 |
A | Fe3+、S2ˉ、Clˉ、Na+ | NaOH溶液 | Fe3++3OHˉ=Fe(OH)3↓ |
B | Na+、Al3+、Clˉ、SO42ˉ | 少量KOH溶液 | Al3++3OHˉ=Al(OH)3↓ |
C | H+、Fe2+、SO42ˉ、NO3ˉ | BaCl 2溶液 | SO42ˉ+Ba2+=BaSO4↓ |
D | Na+、K+、ClOˉ、SO42ˉ | 通入少量SO2 | 2ClOˉ+SO2+H2O=2HClO+SO32ˉ |
查看答案和解析>>
科目:高中化学 来源:2016届江苏省高三上学期9月学情调研化学试卷(解析版) 题型:填空题
四氯化钛(TiCl4)是制取航天航空工业材料——钛合金的重要原料。由钛铁矿(主要成分是FeTiO3)制备TiCl4等产品的一种工艺流程示意图如下:

回答下列问题:
(1)往①中加入铁屑至浸出液显紫色,此时溶液仍呈强酸性。该过程中有如下反应发生:
2Fe3+ + Fe ==== 3Fe2+ 2TiO2+(无色)+ Fe + 4H+==== 2Ti3+(紫色)+ Fe2++2 H2O
Ti3+(紫色)+ Fe3++ H2O ==== TiO2+(无色)+ Fe2++2H+
加入铁屑的作用是 。
(2)在②→③工艺过程中需要控制条件以形成TiO2·nH2O溶胶,该溶胶的分散质颗粒直径大小在_________范围。
(3)写出④中TiO2和焦炭、氯气反应的化学方程式:______________________________。
(4)上述工艺具有成本低、可用低品位矿物为原料等优点。依据绿色化学理念,该工艺流程中存在的不足之处是 (只要求写出一项 )。
(5)依据表格信息,要精制含少量SiCl 4杂质的TiCl 4,可采用 方法。
TiCl4 | SiCl4 | |
熔点/℃ | -25.0 | -68.8 |
沸点/℃ | 136.4 | 57.6 |
查看答案和解析>>
科目:高中化学 来源:2016届广东省高三上学期第二次教学质检化学试卷(解析版) 题型:填空题
(15分)FeCl3 具有净水作用,但腐蚀设备,而聚合氯化铁是一种新型的絮凝剂,处理污水比FeCl3 高效,且腐蚀性小。请回答下列问题:
(1)FeCl3 净水的原理是 。FeCl3 溶液腐蚀钢铁设备,除H+作用外,另一主要原因是(用离子方程式表示) 。
(2)为节约成本,工业上用NaClO3 氧化酸性FeCl2 废液得到FeCl3 。
①若酸性FeCl2 废液中c(Fe2+)=2.0×10-2mol·L-1, c(Fe3+)=1.0×10-3mol·L-1, c(Cl-)=5.3×10-2mol·L-1,则该溶液的PH约为 。
②完成NaClO3 氧化FeCl2 的离子方程式:
 ClO3-+
ClO3-+ Fe2++
Fe2++ =
= Cl-+
Cl-+ Fe3++
Fe3++ .
.
(3)FeCl3 在溶液中分三步水解:
Fe3++H2O 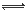 Fe(OH)2++H+——K1
Fe(OH)2++H+——K1
Fe(OH)2++H2O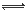 Fe(OH)2++H+——K2
Fe(OH)2++H+——K2
Fe(OH)2++H2O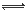 Fe(OH)3+H+——K3
Fe(OH)3+H+——K3
以上水解反应的平衡常数K1、K2、K3由大到小的顺序是 。
(4)FeCl3也可以用作SO2尾气的吸收剂,原理上与NaOH吸收SO2有何不同______________________
(5)电解时,微粒的放电顺序遵循微粒得失电子能力的强弱,SO32—具有强的还原性。用NaOH吸收烟气中的SO2,将所得的Na2SO3溶液用碳棒进行电解,写出阳极电极反应_____________________________
查看答案和解析>>
科目:高中化学 来源:2015-2016学年四川省高二10月月考化学试卷(解析版) 题型:选择题
一定温度下,可逆反应A2(s)+3B2(g)  2AB3(g)达到平衡的标志是( )
2AB3(g)达到平衡的标志是( )
A.容器内每减少1mol A2,同时生成2mol AB3
B.容器内每减少1mol A2,同时消耗3mol B2
C.混合气体总的物质的量不变
D.密闭容器内的物质的质量不再改变
查看答案和解析>>
科目:高中化学 来源:2016届贵州省遵义市高三上学期第一次联考化学试卷(解析版) 题型:选择题
下列离子方程式的书写正确的是
A.Ba(OH)2与H2SO4两稀溶液混合:Ba2++OH- +H++SO42—=BaSO4 ↓+H2O
B.AlCl3溶液中加入过量氨水:Al3++3NH3·H2O=Al(OH)3↓ +3NH4+
C.将Na投入到CuSO4溶液:2Na+Cu2+= 2Na++Cu
D.等物质的量的MgCl2、NaOH和HC1溶液混合:Mg2++2OH一=Mg(OH)2↓
查看答案和解析>>
科目:高中化学 来源:2016届山东省乳山市高三上学期10月月考化学试卷(解析版) 题型:推断题
已知A、B、C、D、E均为中学化学中常见物质,在一定条件下相互转化关系如下图所示(反应条件和部分产物已省略)。已知:
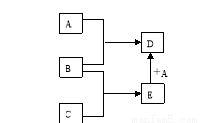
①A常温下为黄绿色的气体单质。
②B为一种常见变价金属单质,在冷的浓硫酸中会被钝化。
③C的水溶液是一种无氧酸,且C的组成中含有与A相同的元素。
请回答下列问题:
(1)A的化学式为 ,构成非金属单质A的元素的最高价氧化物的分子式为 ,C的名称为 。
(2)A与水反应的化学方程式为 。
(3)A与E反应生成D的离子方程式为 。
(4)在E的水溶液中加入足量氢氧化钠溶液,观察到的现象为 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com