(1)人造空气(氧气和氦气的混合气体)可供深水潜水员使用.在标准状况下,5.6L“人造空气”的质量是2.4g,其中氧气与氦气和体积比是______,氧气的质量为______克.
(2)某密闭容器的质量为50g,当装满CO2气体时,质量为58.8g,如果装满CH4气体,此时密闭容器的总质量为______克.
(3)在某温度时,一定量的A元素的气态氢化物AH3在一定体积密闭容器中可完全分解成两种气态单质,此时压强增加了75%.则A单质的一个分子中有______个A原子,AH3分解反应的化学方程式为______.(用A的相关化学式表示,无需推断A是何种元素)
解:(1)设氧气的物质的量是x,氦气的物质的量是y,则
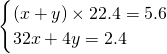
解得
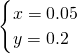
,
相同条件下,氧气和氦气的体积之比等于其物质的量之比=0.05mol:0.2mol=1:4,氧气的质量=0.05mol×32g/mol=1.6g,
故答案为:1:4;1.6;
(2)气体的物质的量为
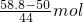
=0.2mol,
则装满甲烷时甲烷的质量为0.2mol×16g/mol=3.2g,
即装满CH
4气体时,此密闭容器的质量50g+3.2g=53.2g,
故答案为:53.2;
(3)设分解后生成A
m,则有2mAH
3=2A
m+3mH
2,密闭容器中气体分子总的物质的量增加了75%,
则有
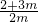
=1+0.75,
m=4,
可得反应的方程式为4AH
3=A
4+6H
2,
故答案为:4;4AH
3=A
4+6H
2.
分析:(1)根据气体的体积和质量列方程式进行计算;
(2)因容器的体积相同,则气体的物质的量相等,利用n=

来计算;
(3)设分解后生成A
m,则有2mAH
3=2A
m+3mH
2,根据反应前后物质的量的关系计算.
点评:本题考查物质的量的相关计算,题目难度中等,注意把握相关计算公式的运用,为解答该题的关键.

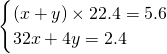 解得
解得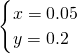 ,
,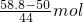 =0.2mol,
=0.2mol,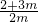 =1+0.75,
=1+0.75, 来计算;
来计算;

 阅读快车系列答案
阅读快车系列答案