
【题目】下列名词与环境污染无关的是
A. 酸雨 B. 光化学烟雾 C. 冻雨 D. 水体富营养化
 新课标快乐提优暑假作业陕西旅游出版社系列答案
新课标快乐提优暑假作业陕西旅游出版社系列答案 暑假衔接培优教材浙江工商大学出版社系列答案
暑假衔接培优教材浙江工商大学出版社系列答案 欣语文化快乐暑假沈阳出版社系列答案
欣语文化快乐暑假沈阳出版社系列答案科目:高中化学 来源: 题型:
【题目】在下列反应中化合物做还原剂的是
A. Br2+2NaI= 2NaBr+ I2 B. Zn+ H2SO4= ZnSO4+H2↑
C. 3C+CaO![]() CaC2+CO↑ D. 2Al+ Fe2O3
CaC2+CO↑ D. 2Al+ Fe2O3![]() 2Fe+ Al2O3
2Fe+ Al2O3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】按要求写化学方程式:
(1)一种单质还原一种化合物_____________________________________
(2)一种单质氧化另一种单质_________________________________________
(3)一种非金属单质还原一种氧化物________________________________________
(4)同一物质中一种元素氧化另一种元素______________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】近年华北地区频繁的雾霾天气已经引起人们的高度重视,化学反应原理可用于治理环境污染,请回答下列问题:
(1)一定条件下,可以用CO处理燃煤烟气生成液态硫,实现硫的回收。
①已知:2CO(g)+O2(g) = 2CO2(g) ΔH= -566 kJ·mol-1
S(l) +O2(g) = SO2(g) ΔH=-296 kJ·mol-1
则用CO处理燃煤烟气的热化学方程式是_____________________。
②在一定温度下,在2 L密闭容器中投入2 mol CO、l mol SO2发生上述反应,达到化学平衡时SO2的转化率为90%,则该温度下该反应的平衡常数K的数值为____________。
(2)SNCR—SCR是一种新型的烟气脱硝技术(除去烟气中的NOx),其流程如下:
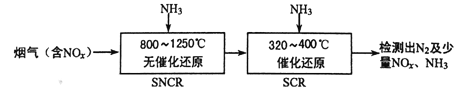
已知该方法中主要反应的热化学方程式:4NH3(g)+4NO(g)+O2(g)![]() 4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是__________________(填字母)。
4N2(g)+6H2O(g) ΔH=-1646 kJ·mol-1,在一定温度下,在密闭恒压的容器中,能表示上述反应达到化学平衡状态的是__________________(填字母)。
a. 4v逆(N2) = v正(O2)
b.混合气体的密度保持不变
c. c(N2)∶c(H2O)∶c(NH3)=4∶6∶4
d.单位时间内断裂4 mol N-H键的同时断裂4 mol![]() 键
键
(3)如图所示,反应温度会直接影响SNCR技术的脱硝效率。
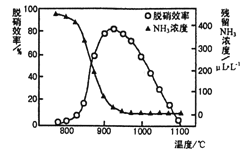
①SNCR技术脱硝的最佳温度选择925 ℃的理由是_____________。
②SNCR与SCR技术相比,SNCR技术的反应温度较高,其原因是________________;但当烟气温度高于1000℃时,SNCR脱硝效率明显降低,其原因可能是__________________。
(4)一种三室微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示:
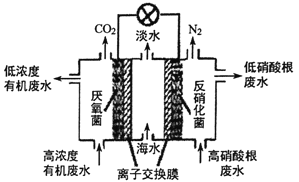
①中间室的Cl-移向_________(填“左室”或“右室”),处理后的含硝酸根废水的pH__________(填“降低”或“升高”)
②若图中有机废水中有机物用C6H12O6表示, 请写出左室发生反应的电极反应式:_________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】根据下列有关图象,说法正确的是
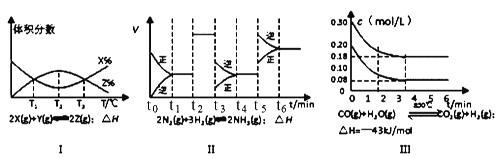
A. 由图Ⅰ知,反应在T1、T3处达到平衡,且该反应的△H<0
B. 由图Ⅱ知,反应在t6时,NH3体积分数最大
C. 由图Ⅱ知,t3时采取的措施是降低反应体系温度
D. Ⅲ在10L容器、850℃时反应,由图知,到4min时,反应放出51.6kJ的热量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将盛有12mLNO2和O2的混合气体的量筒倒立于水槽中,充分反应后,还剩余2mL气体,则原混合气体中O2的体积是
A. 2mL B. 2.4mL C. 3.6mL D. 4mL
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把![]() L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用
L含硫酸铵、硝酸铵的混合溶液分成两等份,一份用![]() mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗
mol烧碱刚好把NH3全部赶出,另一份与氯化钡溶液完全反应消耗![]() molBaCl2,则原溶液中
molBaCl2,则原溶液中![]() (NO3-)为
(NO3-)为
A. ![]() mol·L-1 B.
mol·L-1 B. ![]() mol·1-1 C.
mol·1-1 C. ![]() mol·L-1 D.
mol·L-1 D. ![]() mol·L-1
mol·L-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. SO2能使酸性KMnO4溶液、溴水、品红溶液褪色,且原理相同
B. 不能用澄清石灰水鉴别SO2和CO2
C. 硫粉在过量的纯氧中燃烧可以生成SO3
D. 少量SO2通过浓的CaCl2溶液能生成白色沉淀
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知1 mol不同气体在不同条件下的体积:
化学式 | 条件 | 1 mol气体体积/L |
H2 | 0 ℃、101 kPa | 22.4 |
O2 | 0 ℃、101 kPa | 22.4 |
CO | 0 ℃、101 kPa | 22.4 |
H2 | 0 ℃、202 kPa | 11.2 |
CO2 | 0 ℃、202 kPa | 11.2 |
N2 | 273 ℃、202 kPa | 22.4 |
NH3 | 273 ℃、202 kPa | 22.4 |
(1)从上表分析得出的结论:
①1 mol任何气体,在标准状况下的体积都约为________。
②1 mol不同的气体,在不同的条件下,体积________(填“一定”“一定不”或“不一定”)相等。
(2)理论依据:相同条件下,1 mol任何气体的体积几乎相等,原因是:
①_____________________________________________;
②_____________________________________________。
(3)应用:在标准状况下,4 g O2的体积为多少升?(写出计算过程)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com