
【题目】Na、Al、Fe、Cu是中学化学中重要的金属元素。它们的单质及其化合物之间有很多转化关系。下表所列物质不能按如图(“→”表示一步完成)关系相互转化的是 ( )
选项 | A | B | C | D |
|
a | Na | Al | Fe | Cu | |
b | NaOH | Al2O3 | FeCl3 | CuSO4 | |
c | NaCl | Al(OH)3 | FeCl2 | CuCl2 |
 小学课时作业全通练案系列答案
小学课时作业全通练案系列答案 金版课堂课时训练系列答案
金版课堂课时训练系列答案科目:高中化学 来源: 题型:
【题目】在一密闭容器中进行如下反应2SO2(g)+O2(g)![]() 2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
2SO3(g)测得某一时刻SO2、O2、SO3物质的量浓度分别为0.2mol/L、0.1mol/L、0.2mol/L.当反应达到平衡时,下列数据可能存在的是( )
A.SO2、O2浓度分别为0.4mol/L、0.2mol/L B.SO3浓度为0.4mol/L
C.SO3浓度为0.25mol/L D.SO3、SO2浓度均为0.15mol/L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】一定温度下,在2 L的密闭容器中,X、Y、Z三种气体的物质的量随时间变化的曲线如下图所示:

下列描述正确的是( )
A.反应开始到10 s,用Z表示的反应速率为0.158 mol·(L·s)-1
B.反应开始到10 s,X的物质的量浓度减少了0.79 mol·L-1
C.反应开始到10 s时,Y的转化率为79.0%
D.反应的化学方程式为X(g)+Y(g)====Z(g)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯元素的单质及其化合物在生产生活中应用极其广泛。请完成下列填空:
Ⅰ:氯气性质探究
设计下图实验装置来制备并验证氯气的性质(部分夹持装置未画出)。

(1)A中放置固体二氧化锰的装置名称是___________________。
(2)装置B的作用是___________________。
(3)硬质玻璃管C中事先装有两个沾有相关试剂的棉球,左侧棉球的实验现象为 。
(4)D中的NaOH溶液用来吸收尾气,向反应后的D中加入足量稀硫酸会产生气体,写出该反应的离子方程式 。
Ⅱ:制备HClO
(5)设计装置E代替上图的装置C,用于制备较高浓度的HClO溶液。在圆底烧瓶底部,有一用塑料网包住的过量块状碳酸钙。

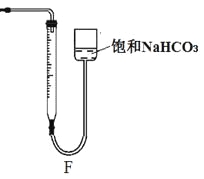
①该方案可以制得较高浓度HClO的原因是(结合必要的化学语言回答) 。
②反应结束后将塑料网中剩余的石灰石提出液面,所得的溶液与稀盐酸混合,立即产生大量CO2气体,则反应所得溶液中的溶质除HClO外,还含有 、 (写两种钙盐的化学式,一种正盐,一种酸式盐);该小组同学测得反应中碳酸钙质量减少M g,反应后从所得的200mL溶液中取用10mL与足量稀盐酸混合,连接F装置测得产生的气体体积为V L(已换算成标准状况),则原溶液中含钙正盐的浓度为 mol·L-1(用含M、V的代数式表示)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】二氧化氯(ClO2)能净化有毒废水中的氰化钠(NaCN),生成NaCl、CO2和N2,下列说法正确的是
A.被氧化的元素是氯元素
B.氧化产物与还原产物的物质的量之比为l:1
C.消耗l mol还原剂,转移5 mol电子
D.净化1 L含CN-1.04 mg·L-1的废水,理论上需用2×l0-5mol C1O2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯气的水溶液称“氯水”,氯水中含有多种分子和离子,因此氯水有多重性质,下列有关新制氯水的说法中不正确的是( )
A.新制氯水呈黄绿色,且有刺激性气味,说明氯水中含有Cl2
B.新制氯水滴在蓝色石蕊试纸上,试纸先变红色后褪色,可说明氯水中含有Cl2
C.向淀粉碘化钾溶液中加入氯水,溶液变成蓝色,说明Cl2可以与盐发生置换反应
D.新制氯水滴到Na2CO3溶液中,有气体产生,说明氯水中含有H+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在实验室里,用50mL的浓盐酸与一定量的MnO2反应,来制取氯气。
(1)用“双线桥法”标出电子转移情况
MnO2+4HCl(浓)![]() MnCl2+Cl2↑+2H2O
MnCl2+Cl2↑+2H2O
(2)若生成2.8L标准状况时的氯气,请计算:
①理论上需要多少克MnO2参加反应?
②被氧化的HCl的物质的量为多少?
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com