
【题目】下列过程属于物理变化的是
A.自来水用氯气消毒B.海水晒盐
C.用海带制单质碘D.用明矾净水
 课前课后同步练习系列答案
课前课后同步练习系列答案 课堂小作业系列答案
课堂小作业系列答案 黄冈小状元口算速算练习册系列答案
黄冈小状元口算速算练习册系列答案 成功训练计划系列答案
成功训练计划系列答案 倍速训练法直通中考考点系列答案
倍速训练法直通中考考点系列答案 一卷搞定系列答案
一卷搞定系列答案 名校作业本系列答案
名校作业本系列答案科目:高中化学 来源: 题型:
【题目】金属在化工生产及日常生活中有着广泛的应用,如铁、铬、镓等在现代工业中备受青睐。
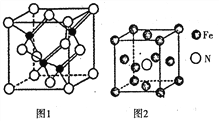
(1)铬是一种硬而脆、抗腐蚀性强的金属,常招于电镀和制造特种钢。基态Cr原子中,未成对电子数有_______个,Cr3+的价电子排布式为________。
(2)Zn与Ga的第一电离能从大到小的顺序为_________。
(3)镓与第VA族元素可形成多种新型人工半导体材料,砷化镓(GaAs)就是其中一种,其晶体结构如图1所示(白色球代表As原子)。在GaAs晶体中,距离每个Ga原子最近的As原子有_____个,距离每个As原子最近的As原子有_______个。
(4)铁的多种化合物均为磁性材料,氮化铁是其中一种,某氮化铁的晶胞结构如图2所示,则氮化铁的化学式为______;设晶胞边长为acm,阿伏加德罗常数为NA,该晶体的密度为 _____g.cm-3 (用含a和NA的式子表示)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用化学原理对工厂排放的废水、废渣等进行有效检测与合理处理。
(一)染料工业排放的废水中含有大量有毒的NO![]() ,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO
,可以在碱性条件下加入铝粉除去(加热处理后的废水会产生能使湿润的红色石蕊试纸变蓝的气体)。除去NO![]() 的离子方程式为____________________。
的离子方程式为____________________。
(二)某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):

常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见下表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是________(至少写一条)。
(2)H2O2的作用是______________。
(3)调pH=8是为了除去__________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(4)钠离子交换树脂的原理为Mn++nNaR―→MRn+nNa+,被交换的杂质离子是____________(填Fe3+、Fe2+、Al3+、Ca2+、Mg2+)。
(5)试配平氧化还原反应方程式:______
![]() Na2Cr2O7+
Na2Cr2O7+![]() SO2+
SO2+![]() H2O===
H2O===![]() Cr(OH)(H2O)5SO4+
Cr(OH)(H2O)5SO4+![]() Na2SO4;
Na2SO4;
每生成1 mol Cr(OH)(H2O)5SO4转移电子的数目为____________。
(三)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10 mol·L-1,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:
①________________________________________________________________________;
②________________________________________________________________________;
③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学是以实验为基础的学科。
演示实验1:金属钠与水的反应是中学化学中的一个重要反应,该反应的演示方法分别如图中①②所示:

(1)现按图①所示的方法,在室温时,向盛有Ca(HCO3)2溶液的水槽中,加入一小块金属钠。下列现象描述正确的是________(填选项字母)。
A.钠浮在液面上,并四处游动,最后消失
B.钠熔化成一个光亮的小球
C.反应开始后,溶液由无色变红色
D.恢复到室温时,烧杯底部有固体物质析出
(2)请补充并完成①实验中从试剂瓶中取出钠到向水槽中投入钠的有关操作:用镊子从试剂瓶中取出一小块钠→_____________→用镊子夹取切好的金属钠投入到盛有Ca(HCO3)2溶液的烧杯中。
(3)按图②所示方法来收集产生的气体,需将钠包好,再放入水中。取相同质量的钠按下列几种情况收集产生的气体在相同条件下体积最大的是________(填选项字母)。
A.用铝箔包住钠
B.用锡箔包住钠
C.直接将钠投入水中
演示实验2:某同学对“铝热反应”的现象有这样的描述:“反应放出大量的热,并放出耀眼的光芒”“纸漏斗的下部被烧穿,有熔融物落入沙中”。查阅《化学手册》知:Al、Al2O3、Fe、Fe2O3的熔点、沸点数据如下:
物质 | Al | Al2O3 | Fe | Fe2O3 |
熔点/℃ | 660 | 2 054 | 1 535 | 1 462 |
沸点/℃ | 2 467 | 2 980 | 2 750 |
(4)设计一个简单的实验方案,证明上述所得的块状熔融物中含有金属铝。该实验所用试剂是________,反应的离子方程式为___________________________。
(5)实验室溶解该熔融物,下列试剂中最好的是________(填选项字母)。
A.浓硫酸 B.稀硫酸
C.稀硝酸 D.氢氧化钠溶液
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】据报道我国科学家最近研制出一种新型“连续纤维增韧”航空材料,其主要成分是由碳化硅、陶瓷和碳纤维复合而成。下列相关叙述不正确的是( )
A. 它耐高温抗氧化
B. 它比钢铁轻、硬,但质地较脆
C. 它没有固定熔点
D. 它是一种新型无机非金属材料
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】1-萘酚用于制染料和香料等,也用于其他有机合成。下面是以1-萘酚为原料合成治疗心脏病的药物“心得安”的路线(具体反应条件和部分试剂略)。
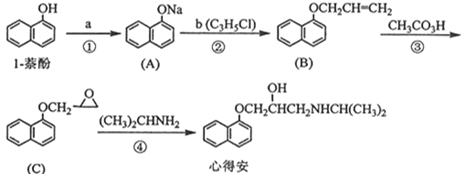
回答下列问题:
(1)试剂b中官能团的名称是_______。③的反应类型是_______。
(2)由丙烷经三步反应制备试剂b的合成路线:
![]()
反应1的试剂与条件为_______,反应2的化学方程式为________,反应3的反应类型是__________。
(3)芳香化合物D是1-萘酚的同分异构体,其分子中有两个官能团,能发生银镜反应,D能被KMnO4酸性溶液氧化成E( C2H4O2) 和芳香化合物F (C8H6O4),E和F与碳酸氢钠溶液反应均能放出CO2气体,F芳环上的一硝化产物只有一种。E的核磁共振氢谱峰面积比为______;名称是_____;D的结构简式为__________;由F生成一硝化产物的化学方程式为_____________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ、(1)在Fe(OH)3胶体中逐渐滴入HI稀溶液,会出现一系列变化。
①先出现红褐色沉淀,原因是_________________________________________。
②随后沉淀溶解,溶液呈黄色,此反应的离子方程式是________________________。
③最后溶液颜色加深,此反应的离子方程式是________________________________。
(2)若用稀盐酸代替HI稀溶液,能出现(1)中所述变化现象中的____(填写上面各题序号)。
Ⅱ、某一反应体系中有反应物和生成物共五种物质:O2、H2CrO4、Cr(OH)3、H2O、H2O2。已知该反应中H2O2只发生如下过程:H2O2―→O2。
(1)该反应中,发生还原反应的过程是____________―→______________。
(2)写出该反应的化学方程式,并标出电子转移的方向和数目。
__________________________________________________________。
(3)如反应转移了0.3 mol电子,则产生的气体在标准状况下体积为______。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com