
下表为元素周期表的一部分,列出10种元素在周期表中的位置。用化学符号回答下列问题:
|
|
IA |
IIA |
IIIA |
IVA |
VA |
VIA |
VIIA |
0 |
|
第2周期 |
|
|
|
⑥ |
|
⑦ |
|
|
|
第3周期 |
① |
③ |
⑤ |
|
|
|
⑧ |
⑩ |
|
第4周期 |
② |
④ |
|
|
|
|
⑨ |
|
(1)10种元素中,化学性质最不活泼的是________。
(2)①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是___。
(3)②、③、④三种元素形成的离子,离子半径由大到小的顺序是_____。
(4)元素⑦的氢化物的化学式为________;该氢化物常温下和元素⑧的单质反应的化学方程式为______________________。
(5)①和⑨两种元素形成化合物的化学式为______,该化合物燃烧时的焰色为______,该化合物溶液与元素⑧的单质反应的化学方程式为________________。
(1)Ar (2)NaOH (3)K+ Ca2+ Mg2+ (4)H2O Cl2+H2O=HCl+HClO
(5)NaBr 黄色 Cl2+2NaBr=Br2+2NaCl
【解析】
试题分析:(1)由于稀有气体元素的最外层电子数已经达到稳定结构,所以化学性质最不活泼的是Ar。
(2)金属性越强,最高价氧化物对应的水化物碱性就越强。由于同周期自左向右金属性逐渐减弱,所以①、③、⑤三种元素最高价氧化物对应的水化物中,碱性最强的是NaOH。
(3)②、③、④三种元素形成的离子分别是K+、Mg2+、Ca2+,由于镁离子核外只有2层电子,所以镁离子半径最小。对于核外电子排布相同的微粒,其微粒半径随原子序数的增大而减小,钾元素的原子序数小于钙元素的,因此钾离子半径大于钙离子半径,所以三种离子半径由大到小的顺序是K+、Ca2+、Mg2+。
(4)元素⑦是氧元素,其氢化物的化学式为H2O;元素⑧的单质是氯气,和水反应的化学方程式是Cl2+H2O=HCl+HClO。
(5)①和⑨两种元素分别是Na和Br,二者形成化合物的化学式为NaBr;钠元素的焰色反应是黄色的,所以NaBr燃烧时的焰色为黄色;氯元素的非金属性强于溴元素的,所以氯气能和溴化钠反应置换出单质溴,反应的化学方程式是Cl2+2NaBr=Br2+2NaCl。
考点:考查元素周期表的结构和元素周期律的应用
点评:本题属于基础性试题,难度不大。本题主要是元素“位、构、性”三者关系的综合考查,比较全面考查学生有关元素推断知识和灵活运用知识解决实际问题的能力。


 应用题作业本系列答案
应用题作业本系列答案科目:高中化学 来源: 题型:
| a | |||||||||||||||||
| f | y | h | i | ||||||||||||||
| b | e | j | |||||||||||||||
| c | d | g | l | ||||||||||||||




查看答案和解析>>
科目:高中化学 来源: 题型:阅读理解
| 族 周期 |
IA | 0 | ||||||
| 1 | ① | IIA | IIIA | IVA | VA | VIA | VIIA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ | ||||





查看答案和解析>>
科目:高中化学 来源: 题型:



查看答案和解析>>
科目:高中化学 来源: 题型:
| 族周期 | IA | 0 | ||||||
| 1 | ① | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | |
| 2 | ② | ③ | ④ | |||||
| 3 | ⑤ | ⑥ | ⑦ | ⑧ |



查看答案和解析>>
科目:高中化学 来源: 题型:
| 第一周期 | 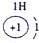 |
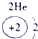 | ||||||
| 第二周期 | 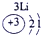 |
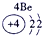 |
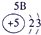 |
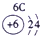 |
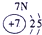 |
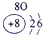 |
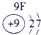 |
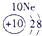 |
| 第三周期 | 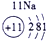 |
 |
 |
 |
 |
 | ||
 表示的是
表示的是查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com