
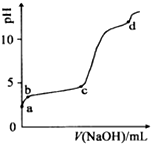
| A. | a点溶液呈酸性的原因是Al3+水解,离子方程为:Al3++3OH-?Al(OH)3 | |
| B. | c点铝元素主要以Al(OH)3的形式存在 | |
| C. | a-b段,溶液pH增大,Al3+浓度不变 | |
| D. | d点Al(OH)3沉淀开始溶解 |
分析 室温下,往0.2mol/LAl2 ( SO4)3溶液中逐滴加入1.0mol/L NaOH溶液,硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2O?Al(OH)3+3H+;a-b段,加入NaOH溶液,消耗氢离子,发生反应:H++OH-═H2O,b-c段溶液的pH变化不大,主要发生反应:Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀;c-d段溶液pH变化较大,c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,据此进行解答.
解答 解:室温下,往0.2mol/LAl2 ( SO4)3溶液中逐滴加入1.0mol/L NaOH溶液,硫酸铝为强酸弱碱盐,水解显酸性,水解离子反应为Al3++3H2O?Al(OH)3+3H+;a-b段,加入NaOH溶液,消耗氢离子,发生反应:H++OH-═H2O,b-c段溶液的pH变化不大,主要发生反应:Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀;c-d段溶液pH变化较大,c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,
A.硫酸铝为强酸弱碱盐,铝离子水解导致溶液显酸性,水解离子反应为Al3++3H2O?Al(OH)3+3H+,故A错误;
B.b-c段溶液的pH变化不大,主要发生反应:Al3++3OH-═Al(OH)3↓,则加入的OH-主要用于生成Al(OH)3沉淀;c-d段溶液pH变化较大,c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,所以c点铝元素主要以Al(OH)3的形式存在,故B正确;
C.a-b段,发生H++OH-═H2O,但加入NaOH溶液,总体积增大,则Al3+浓度减小,故C错误;
D.c点后pH发生突变,NaOH过量,Al(OH)3沉淀开始溶解,生成NaAlO2,碱性较强,而d点pH>10,NaOH远远过量,故D错误;
故选B.
点评 本题考查离子反应方程式的有关计算,为高频考点,侧重考查学生分析判断能力,明确对应点溶液中溶质成分及其性质是解本题关键,注意氢氧化铝的两性,题目难度中等.


 开心练习课课练与单元检测系列答案
开心练习课课练与单元检测系列答案科目:高中化学 来源: 题型:选择题
| A. | ${\;}_{a}^{b}$R | B. | ${\;}_{a-2}^{a+b-2}$R | C. | ${\;}_{a+2}^{a+b+2}$R | D. | ${\;}_{a-2}^{a+b}$R |
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
| 元素编号 | 元素性质或原子结构 |
| A | 有三个电子层,且K、M层电子数之和等于L层电子数 |
| B | 最外层电子数是次外层电的2倍 |
| C | 常温下单质为双原子分子,其氢化物的水溶液呈碱性 |
| D | 元素最高正价是+7价 |
 .
.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
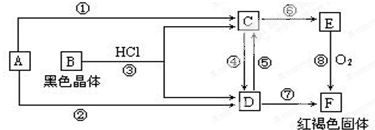
查看答案和解析>>
科目:高中化学 来源: 题型:推断题
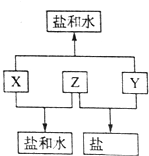 已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.
已知:A、B、C、D四种短周期元素,A与D原子序数之和等于B与C的原子序数之和,由D元素组成的单质在通常状况下呈黄绿色,B、C、D三种元素位于同一周期,A、B、C三种元素的最高价氧化物对应的水化物分别为X、Y、Z,且存在如下转化关系,已知Z是常见的两性氢氧化物,试推断回答下列问题.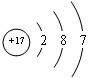 ;
;查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | X>Y>Z>W | B. | Y>X>W>Z | C. | Z>X>Y>W | D. | Z>Y>X>W |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | FeCl2(aq)$\stackrel{Cl_{2}}{→}$FeCl3(aq)$\stackrel{Cu}{→}$FeCl2(aq) | B. | H2SO3$\stackrel{△}{→}$Si02$\stackrel{HCl}{→}$SiCl4 | ||
| C. | NaCl(aq)$\stackrel{CO_{2}}{→}$NaHC03(s)$\stackrel{△}{→}$Na2CO3(s) | D. | CuS04 $\stackrel{NaOH(aq)}{→}$Cu(OH)2$→_{△}^{乙醛}$Cu |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com