
| A、CN-中碳元素的化合价为+2 |
| B、该反应的产物之一是无毒的N2 |
| C、当1 mol CN-参与反应时,转移3 mol e- |
| D、处理含0.1 mol CN-的废水,理论上需要消耗标准状况下Cl2的体积为5.6 L |


科目:高中化学 来源: 题型:
| 物 质 | A | B | C | D |
| 起始投料/mol | 2 | 1 | 2 | 0 |
| A、该反应是吸热反应 |
| B、该反应的平衡常数随温度的升高而增大 |
| C、压强升高时平衡常数也随之增大 |
| D、该反应的平衡常数随温度的升高而减小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
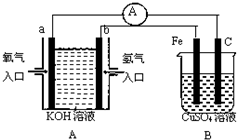 根据如图所示装置回答问题:
根据如图所示装置回答问题:查看答案和解析>>
科目:高中化学 来源: 题型:
| A、氧化性:Sn4+<Sn2+ |
| B、氧化性:Fe3+<Sn4+ |
| C、还原性:Fe2+<Sn2+ |
| D、还原性:Fe<Sn |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、金属钠与水反应:Na+2H2O=Na++2OH-+H2↑ |
| B、金属铝投入NaOH溶液中:Al+2OH-=AlO2-+H2↑ |
| C、稀硝酸中加入过量铁粉:Fe+4H++NO3-=Fe3++NO↑+2H2O |
| D、FeCl2酸性溶液放在空气中变质:4Fe2++4H++O2=4Fe3++2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
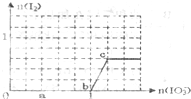 已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )
已知:还原性还原性HSO3->I-,氧化性IO3->I2.在含3mol NaHSO3的溶液中逐滴加入KIO3溶液.加入KIO3和析出I2的物质的量的关系曲线如图所示.下列说法正确的是( )| A、反应过程中的氧化产物均为SO3 |
| B、a点时剩余NaHSO3的物质的量为1.2 mol |
| C、b点时的还原产物可能是KI或NaI |
| D、当溶液中I-与I2的物质的量之比为1:1时,加入的KIO3为1.1mol |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com