
【题目】由下列实验操作及现象能得出相应结论的是
操作 | 现象 | 结论 | |
A. | 将蘸有浓氨水的玻璃棒靠近某溶液 | 有白烟产生 | 该溶液一定为浓盐酸 |
B. | 向 CH3COONa 溶液中滴入酚酞试液,加热 | 加热后红色加深 | CH3COONa 水解是吸热反应 |
C. | 向某溶液中加入盐酸,将产生 的气体通入澄清石灰水 | 澄清石灰水变浑浊 | 该溶液中一定有 CO32— |
D. | 向 NaCl 溶液中滴加过量 AgNO3 溶液,再滴加 KI 溶液 | 先出现白色沉淀, 后出现黄色沉淀 | Ksp(AgI) < Ksp(AgCl) |
A. A B. B C. C D. D
【答案】B
【解析】
A. 蘸有浓氨水的玻璃棒靠近溶液X有白烟产生,应为挥发性酸,不一定为浓盐酸,也可能为浓硝酸等,故A错误;
B. 盐类的水解是一个吸热过程:CH3COO-+H2O![]() CH3COOH+OH- ΔH>0,加热可促进CH3COO-的水解平衡正向移动,c(OH-)增大,pH增大,溶液的红色加深,故B正确;
CH3COOH+OH- ΔH>0,加热可促进CH3COO-的水解平衡正向移动,c(OH-)增大,pH增大,溶液的红色加深,故B正确;
C. 向某溶液中加入稀盐酸,产生的气体通入澄清石灰水,石灰水变浑浊,该溶液可能是碳酸盐溶液也可能是含有HCO3-或SO32-等的溶液,故C错误;
D. 向 NaCl 溶液中滴加过量AgNO3 溶液,再滴加KI溶液先出现白色沉淀,后出现黄色沉淀,由于AgNO3溶液过量,加入的KI与过量的AgNO3产生黄色AgI沉淀,不能说明AgCl转化为AgI,不能确定AgI、AgCl溶度积的大小,故D错误。
故选B。


 英语小英雄天天默写系列答案
英语小英雄天天默写系列答案 暑假作业安徽少年儿童出版社系列答案
暑假作业安徽少年儿童出版社系列答案科目:高中化学 来源: 题型:
【题目】下图是某元素及其重要化合物之间的相互转化关系图(生成物中不含该元素的物质均已略去)。其中A是单质,D在常温下呈气态,F可用作氮肥。
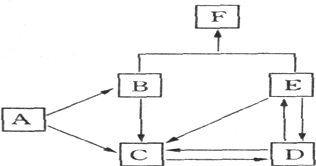
据此,请回答下列问题:
(1)写出以下物质的化学式:A________,D______,F__________。
(2)写出下列变化的化学方程式:
B→C______________________________________________
E→C______________________________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列热化学方程式正确的是( )
A. 甲烷的燃烧热为890.3 kJ·mol-1,则甲烷燃烧热的热化学方程式可表示为:CH4(g)+2O2(g)==CO2(g)+2H2O(g) ΔH=-890.3 kJ·mol-1
B. 500 ℃、30 MPa 下,将0.1 mol N2 和 0.3 mol H2 置于密闭容器中充分反应生成NH3(g),放热3.86 kJ,其热化学方程式为:N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6 kJ·mol-1
2NH3(g) ΔH=-38.6 kJ·mol-1
C. 已知1 g液态肼和足量液态过氧化氢反应生成氮气和水蒸气时放出20.05 kJ的热量,肼和过氧化氢反应的热化学方程式为:N2H4(l)+2H2O2(l)===N2(g)+4H2O(g) ΔH=-641.6 kJ·mol-1
D. CO的燃烧热是283.0kJ/mol,则2CO2(g)=2CO(g)+O2(g) △H=+283.0kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】铝和氟的化合物在制造、化工等领域都有广泛应用。回答下列问题:
(1)基态铝原子的核外电子排布式为___________,占据最高能级的电子的电子云轮廓图形状为___________,基态铝原子比基态镁原子的第一电离能(I1)小,其原因是___________。
(2)通常情况下,AlF3可由六氟铝酸铵[(NH4)3AlF6]受热分解制得,请写出该反应的化学方程式______________________。
(3)AlF3具有较高的熔点(1040℃),属于___________晶体(填晶体类型);AlCl3在178℃时升华,写出导致AlF3、AlCl3具有不同晶体类型的原因(从原子结构与元素性质的角度作答)___________。
(4)NaAlO2在水溶液中实际上都是以Na[Al(OH)4]形式存在。其中[Al(OH)4]-为配离子,写出Al原子的杂化形式___________,该阴离子中存在的化学键有___________(填字母代号)
A.离子键 B.极性键 C.非极性键 D.金属键 E.配位健 F.氢键
(5)萤石CaF2晶体的晶胞如图所示,其中Ca2+的堆积方式称为___________。立方体边长为acm,阿伏加德罗常数的值为NA,则CaF2晶体的密度为___________g·cm-3(列出计算式)

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设 NA 为阿伏加德罗常数的值。下列说法正确的是( )
A. 密闭容器中,2 mol SO2 和足量 O2 充分反应,产物的分子数为 2 NA
B. 含 NA个 CO32-的 Na2CO3 溶液中,Na+数目为 2 NA
C. 11.2 L 甲烷和乙烯的混合物中含氢原子数目为 2 NA
D. 4.0 g CO2 气体中含电子数目为 2 NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】除去Na2CO3固体中混有的少量NaHCO3,可采取的方法是( )
A. 加热 B. 通入过量的CO2 C. 加入过量的石灰水 D. 加入稀盐酸
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( )
A.碘易升华,可保存在酒精中
B.液溴应保存在棕色磨口玻璃塞的试剂瓶中,并加少量水进行水封
C.新制的氯水可长期保存在无色玻璃瓶中
D.碘易溶于酒精,所以可用酒精从碘水中萃取碘
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】设NA为阿伏加德罗常数的值,下列说法正确的是( )
A. 0.1 mol丙烯酸中含有的双键数目为0.1NA
B. 常温常压下,4.6 g NO2和N2O4的混合气体中分子总数为0.3NA
C. 标准状况下,2.24 L Cl2溶于足量的水中充分反应后,溶液中Cl-数为0.2NA
D. 7.8 g Na2O2和Na2S的固体混合物中含有的离子总数为0.3NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】X、Y、Z、W四种化合物均由短周期元素组成。其中X含有四种元素,X、Y、Z的焰色反应均为黄色,W为无色、无味气体。这四种化合物具有如下图所示转化关系(部分反应物、产物及反应条件已略去)。
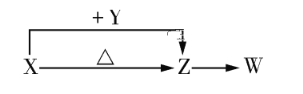
请回答下列问题:
(1)X与Y在溶液中反应的离子方程式是_____________。
(2)X含有的四种元素之间(二种、三种或四种)可组成多种化合物,选用其中某些化合物,利用下图装置(夹持固定装置已略去)进行实验,装置Ⅲ中产生白色沉淀,装置Ⅴ中可收集到一种无色气体。
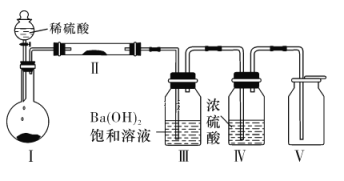
①装置Ⅰ中反应的化学方程式是_______。
②用X含有的四种元素中的两种组成的某化合物,在催化剂存在下制备并收集纯净、干燥的装置Ⅴ中的气体,该化合物的化学式是_______,所需仪器装置是_______(从上图选择必要装置,填写编号)。
(3)向Z溶液中通入氯气,可制得某种生产和生活中常用的漂白、消毒的物质,同时有X生成,该反应的化学方程式是____。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com