
(16分)Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
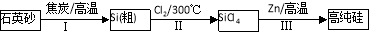
(1)焦炭在过程Ⅰ中做 剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为 。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g) △H2<0
Si(S)+2ZnCl2(g) △H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g) △H3<0
Si(S)+2ZnCl2(g) △H3<0
i. 反应②的平衡常数表达式为 。
ii. 对于上述三个反应,下列说明合理的是 。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为 。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为 。
Ⅰ.(1)还原剂(1分) (2)2NaCl+H2O电解2NaOH+Cl2↑+H2↑(2分)
(3)①SiCl4+2H2O=SiO2+4HCl(2分)
②使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性(1分),同时降低放出的热量(1分)。i. K=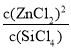 (1分) ii. b c d(完全正确2分,选一个正确1分,有错为零分)
(1分) ii. b c d(完全正确2分,选一个正确1分,有错为零分)
(5)SiO2+6HF=H2SiF6+2H2O(2分)
Ⅱ.(1)CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-(a-2b-2c)KJ/mol(2分)
(2)Ag2CrO4>AgCl>AgI(2分)
【解析】
试题分析:(1)碳在高温下与二氧化硅反应生成CO和硅,碳元素化合价升高,被氧化,作还原剂,因此焦炭在过程Ⅰ中做还原剂。
(2)电解饱和食盐水生成氢氧化钠、氢气和Cl2,反应的化学方程式为2NaCl+H2O电解2NaOH+Cl2↑+H2↑。
(3)①①SiCl4遇水剧烈水解生成SiO2和一种酸,根据原子守恒可知该酸应该是盐酸,则反应的化学方程式为SiCl4+2H2O=SiO2+4HCl。
②如果不降低温度,则水蒸气会被浓硫酸稀释,降低浓硫酸的性能,所以冷却的作用是使水蒸气冷凝,减少进入浓硫酸的水,保持浓硫酸持续的吸水性,同时降低放出的热量。
(4)i. 化学平衡常数是在一定条件下,当可逆反应达到平衡状态时,生成物浓度的幂之积和反应物浓度的幂之积的比值,又因为固体或纯液体不能表示平衡常数,因此反应②的平衡常数表达式为K=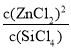 。
。
ii.a.正方应是放热反应,升高温度平衡向逆反应方向移动,则会降低SiCl4的转化率,a不正确;b.由于锌是活泼的金属,即使存在氧气,也不会与硅反应,而是与锌反应,因此还原过程需在无氧的气氛中进行,b正确;c.正方应是体积减小的可逆反应,则增大压强平衡向正反应方向移动,能提高反应速率,c正确;d.Na、Mg的活泼性均强于锌,可以代替Zn还原SiCl4,d正确,答案选bcd。
(5)根据原子守恒可知,反应中还有水生成,则反应的化学方程式为SiO2+6HF=H2SiF6+2H2O。
Ⅱ.(1)燃烧热是在一定条件下,1mol可燃物完全燃烧生成稳定的氧化物时所放出的热量,所以甲烷、氢气、一氧化碳完全燃烧的热化学方程式分别为①CH4(g)+ O2(g)=CO2(g)+2H2O(l) △H=-a kJ/mol、②2CO(g)+ O2(g)=2CO2(g) △H=-2b kJ/mol、③O2 (g)+2H2(g)=2H2O(l) △H=-2c kJ/mol,所以根据盖斯定律可知①-(②+③)即得到CH4(g)+CO2(g)=2CO(g)+2H2(g) △H=-(a-2b-2c)KJ/mol。
(2)由ksp表达式可知AgCl中c(Ag+)=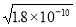 ,AgI中c(Ag+)=
,AgI中c(Ag+)=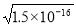 ,Ag2CrO4中Ag+为x,则
,Ag2CrO4中Ag+为x,则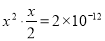 ,解得
,解得 ,所以Ag+浓度大小的顺序为Ag2CrO4>AgCl>AgI。
,所以Ag+浓度大小的顺序为Ag2CrO4>AgCl>AgI。
考点:考查二氧化硅提纯反应条件可知、外界条件对反应速率和平衡状态的影响、热化学方程式书写以及溶解平衡应用等


 出彩同步大试卷系列答案
出彩同步大试卷系列答案科目:高中化学 来源:2013-2014四川省成都市高第二期期末高一化学试卷(解析版) 题型:选择题
下列实验可行或叙述正确的是 ( )
①.不能用闻气味的方法区分丝织品和棉织物
②.蔗糖加稀硫酸的水解液,再加新制Cu(OH)2悬浊液共热会产生砖红色沉淀
③.乙酸乙酯、油脂在碱性条件下水解均可制肥皂
④.用浓硫酸与蛋白质的颜色反应鉴别部分蛋白质
⑤. 金属的冶炼都是置换反应
⑥.漂白粉、玻璃、脂肪是混合物,水银、明矾、蔗糖是纯净物
⑦.盐酸、BaSO4是强电解质,氨水是弱电解质,苯、四氯化碳是非电解质
⑧.符合n(C) :n(H)=n:(2n+2)的物质一定是烷烃
⑨. 煤中含苯及甲苯,可以用先干馏后分馏的方法把它们分离出来
⑩. 离子键只存在于离子化合物中,共价键只存在于共价化合物和离子化合物中
A.⑤⑥⑧⑨⑩ B.①⑥ C.①⑤⑥⑨⑩ D.②③⑦⑨
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:填空题
A、B、C、D代表元素周期表中4种元素,请完成下列问题
(1)A元素的基态原子的最外层有3个未成对电子,次外层有2个电子,该元素氢化物比同族元素氢化物熔沸点高的原因是 ;第一电离能比后面一号元素大的原因是
(2)B元素与氧元素形成的一种化合物是含有4个原子18个电子的分子,该化合物的电子式为 ,若向该化合物的稀溶液中加入少量二氧化锰,有无色气体产生,该反应的化学方程式为
(3)C元素的正三价离子的 3d轨道为半充满状态,C元素的符号为 ,在同期表中位于 周期 族,原子结构示意图为
(4)D元素位于元素周期表第四周期第ⅠB族,其基态原子的电子排布式为
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
常温下,Ksp(CaSO4)=9×l0-6,常温下CaSO4在水中的沉淀溶解平衡曲线如图。下列判断错误的是
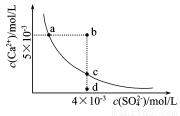
A.a、c两点均可以表示常温下CaSO4溶于水所形成的饱和溶液
B.a点对应的Ksp不等于c点对应的Ksp
C.b点将有沉淀生成
D. 向d点溶液中加入适量CaCl2固体可以变到c点
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
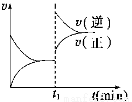
A.2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g) 2HI(g) ΔH>0
2HI(g) ΔH>0
D.2A(g)+B(s) 2C(g) ΔH>0
2C(g) ΔH>0
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
下列有关实验操作,现象和结论都正确的是
选项 | 实验操作 | 现象 | 结论 |
A | 将过量CO2通入CaCl2溶液中 | 无白色沉淀 | 生成Ca(HCO3)2溶于水 |
B | 常温下将Al片插入浓硫酸中 | 无明显现象 | Al片和浓硫酸不反应 |
C | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
D | 将SO2通入溴水中 | 溶液褪色 | SO2具有漂白性 |
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:填空题
(10分)2006年5月,齐齐哈尔第二制药厂生产的假药“亮菌甲素注射液”导致多名患者肾功能衰竭。“亮菌甲素”的结构简式为:
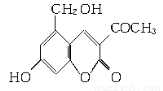
它配以辅料丙二醇溶成针剂用于临床。假药中使用廉价的二甘醇作为辅料,二甘醇为工业溶剂,有很强的毒性。请回答下列问题:
(1)“亮菌甲素”的分子式为________。
(2)丙二醇的分子式是C3H8O2,已知两个羟基连在同一个碳原子上的物质不存在。 写出其属于醇类的同分异构体的结构简式___________________________________________________。
(3)下列有关“亮菌甲素”的叙述正确的是________(填字母)。
A.“亮菌甲素”能与H2发生加成反应
B.不能使酸性KMnO4溶液褪色
C.“亮菌甲素”分子中含氧官能团只有2种
D.1 mol“亮菌甲素”最多与3 mol NaOH反应
(4)核磁共振氢谱分析,发现二甘醇分子中有3个吸收峰,其峰面积之比为2∶2∶1。又知二甘醇中C、O元素的质量分数相同,且H的质量分数为9.4%,1 mol二甘醇与足量金属钠反应生成1 mol H2。写出二甘醇与乙酸(按物质的量之比1∶1)反应的化学方程式 。
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
分类是化学研究的重要方法之一,下列有关说法中,正确的是
A.SO2、NO2、和CO2都属于酸性氧化物
B.甲烷和和一氯甲烷都属于烷烃
C.HC1O是弱电解质,NaClO却属于强电解质
D.在水溶液中能电离出H+的化合物都属于酸
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:选择题
体积相同的甲、乙两个容器中,分别充入等物质的量的SO2和O2,在相同温度下发生反应:2SO2(g)+O2(g) 2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
2SO3(g),并达到平衡,在此过程中,甲容器保持体积不变,乙容器保持压强不变,若甲容器中SO2的转化率为p%,则乙容器中SO2的转化率为
A.等于p% B.大于p% C.小于p% D.无法比较
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com