
如图为某化学反应的速率与时间的关系示意图。在t1时刻升高温度或增大压强,速率的变化都符合示意图的反应是
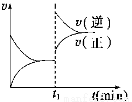
A.2SO2(g)+O2(g) 2SO3(g) ΔH<0
2SO3(g) ΔH<0
B.4NH3(g)+5O2(g) 4NO(g)+6H2O(g) ΔH<0
4NO(g)+6H2O(g) ΔH<0
C.H2(g)+I2(g) 2HI(g) ΔH>0
2HI(g) ΔH>0
D.2A(g)+B(s) 2C(g) ΔH>0
2C(g) ΔH>0
B
【解析】
试题分析:有图像可知增大压强或升高温度后,V正、V逆都增大,由于V逆增大的多,所以平衡逆向移动。A.该反应的正反应为气体体积减小的放热反应。增大压强,平衡正向移动,升高温度,平衡逆向移动,与题意不符合。B。该反应的正反应为气体体积增大的放热反应。增大压强,化学平衡逆向移动;升高温度,化学平衡逆向移动,与题意相符合。正确。C. 该反应是反应前后气体体积相等的可逆反应。正反应是吸热反应。增大压强,平衡不移动;升高温度,平衡正向移动,与题意不符合。错误。D.该反应的正反应为反应前后气体体积不等的吸热反应。增大压强,化学平衡不移动;升高温度,平衡正向移动。与题意不符合。错误。
考点:考查压强、温度对化学平衡移动的影响的知识。


科目:高中化学 来源:2013-2014四川省成都市五校高一下学期期中联考化学试卷(解析版) 题型:选择题
下列物质中,既含离子键又含非极性共价键的是 ( )
A、Na2O2 B、H2O C、HClO D、NaOH
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
能用键能知识解释的是
A.稀有气体的化学性质很不活泼 B.HCl气体比HI气体稳定
C.干冰易升华 D.HF熔沸点高于HCl
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省宜昌市春季期中考试高二化学试卷(解析版) 题型:选择题
在密闭容器中,对于可逆反应A+3B 2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
2C(气),平衡时C的体积分数与温度和压强的关系如图所示,下列判断正确的是
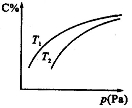
A.若正反应方向ΔH<0,则T1>T2
B.压强增大时,混合气体的平均相对分子质量减小
C.B一定为气体
D.A一定为气体
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:简答题
(16分)Ⅰ.硅是信息产业、太阳能电池光电转化的基础材料。锌还原四氯化硅是一种有着良好应用前景的制备硅的方法,该制备过程示意图如下:
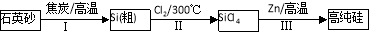
(1)焦炭在过程Ⅰ中做 剂。
(2)过程Ⅱ中Cl2用电解饱和食盐水制备,制备Cl2的化学方程式为 。
(3)整过生产过程必须严格控制无水。
①SiCl4遇水剧烈水解生成SiO2和一种酸,反应方程式为 。
②干燥Cl2时从有利于充分干燥和操作安全的角度考虑,需将约90℃的潮湿氯气先冷却至12℃,然后再通入浓H2SO4中。冷却的作用是 。
(4)Zn还原SiCl4的反应如下:
反应①:400℃~756℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(l) △H1<0
Si(S)+2ZnCl2(l) △H1<0
反应②:756℃~907℃,SiCl4(g)+2Zn(l) Si(S)+2ZnCl2(g) △H2<0
Si(S)+2ZnCl2(g) △H2<0
反应③:907℃~1410℃,SiCl4(g)+2Zn(g) Si(S)+2ZnCl2(g) △H3<0
Si(S)+2ZnCl2(g) △H3<0
i. 反应②的平衡常数表达式为 。
ii. 对于上述三个反应,下列说明合理的是 。
a.升高温度会提高SiCl4的转化率 b.还原过程需在无氧的气氛中进行
c.增大压强能提高反应速率 d.Na、Mg可以代替Zn还原SiCl4
(5)用硅制作太阳能电池时,为减弱光在硅表面的反射,可用化学腐蚀法在其表面形成粗糙的多孔硅层。腐蚀剂常用稀HNO3和HF的混合液。硅表面首先形成SiO2,最后转化成H2SiF6。用化学方程式表示SiO2转化为H2SiF6的过程 。
Ⅱ.(1)甲烷、氢气、一氧化碳的燃烧热分别为akJ·mol-1,bkJ·mol-1,ckJ·mol-1,工业上利用天燃气和二氧化碳反应制备合成气(CO、H2),其热化学反应方程式为 。
(2)已知Ksp(AgCl)=1.8×10-10,Ksp(AgI)=1.5×10-16,Ksp(Ag2CrO4)=2.0×10-12,三种难溶盐的饱和溶液中,Ag+浓度大小的顺序为 。
查看答案和解析>>
科目:高中化学 来源:2013-2014四川省高三5月冲刺卷理综化学试卷(解析版) 题型:选择题
下列解释实验事实的化学方程式正确的是
A.5molFe和4molCl2反应:5Cl2+4Fe点燃2FeCl2+2FeCl3
B.2molKMnO4和3molH2O2在酸性条件下反应:2MnO4-+3H2O2+6H+=Mn2++4O2↑+6H2O
C.在电解液为氢氧化钾的甲醇燃料电池内电路中,阳极的电极反应式为:CH3OH-6e-+8OH-=CO32-+6H2O
D.向NaAlO2溶液中通入过量CO2:CO2+3H2O+2AlO2-=2Al(OH)3↓+CO32-
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省长春市高二下学期期末考试化学试卷(解析版) 题型:选择题
某实验小组依据反应 设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是
设计如图原电池,探究pH对AsO43-氧化性的影响。测得电压与pH的关系如图。下列有关叙述错误的是

A.调节pH可以改变反应的方向
B.pH = 0.68时,反应处于平衡状态
C.pH = 5时,负极电极反应式为2I--2e- =I2
D.pH >0.68时,氧化性I2〉AsO43-
查看答案和解析>>
科目:高中化学 来源:2013-2014吉林省白城市高二上学期期末考试化学(B卷)试卷(解析版) 题型:填空题
现有室温下浓度均为1×10-3mol/L的几种溶液:
①盐酸、②硫酸、③醋酸、④氯化铵、⑤氨水、⑥NaOH,回答下列问题:
(1)将③、⑥混合后,若溶液呈中性,则消耗两溶液的体积为③ ________ ⑥(填“>”、“<”或“=”)溶液中的离子浓度由大到小的顺序为
(2)将等体积的①、⑤混合,则溶液的pH ________ 7(填“>”、“<”或“=”)
用离子方程式说明其原因 _______________________
(3)向相同体积的①、②、③溶液中分别加入相同的且足量的锌粒,反应的初始速率由快到慢的为________ (填写序号)
最终产生H2总量的关系为___________(填写序号)
(4)向相同体积的①、③溶液中分别加入相同浓度、相同体积的CH3COONa溶液,充分混合后,混合液的pH 大小关系为① _________ ③(填“>”、“<”或“=”)
(5)将等体积的⑤、⑥溶液加热至同温度后,溶液的pH ⑤ _____ ⑥(填“>”、“<”或“=”)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com