
【题目】下列事实不能用勒夏特列原理解释的是( )
A. 对于2HI(g)![]() H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
B. 已知, N2 (g) + 3 H2(g)![]() 2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
2NH3(g) △H﹤0 ,为提高氨的产率,理论上应采取降低温度的措施
C. 反应CO(g)+NO2(g)![]() CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
CO2(g)+NO(g)△H﹤0,达平衡后,升高温度体系颜色变深
D. 溴水中有下列平衡Br2+H2O![]() HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
HBr+HBrO,当加入硝酸银溶液后,溶液颜色变浅
科目:高中化学 来源: 题型:
【题目】对图中的表述中正确的是( )
A.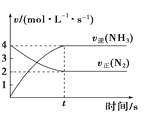 图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
图中两条线的交点可表示反应N2(g)+3H2(g)2NH3(g)达到了平衡
B. 图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
图中所介绍的电池使用后埋入地下会污染土壤,应投入火中焚烧彻底销毁
C.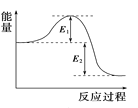 图可表示某化学反应属于放热反应,放出的能量为E1+E2
图可表示某化学反应属于放热反应,放出的能量为E1+E2
D.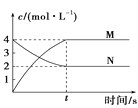 图涉及的反应可能为N(aq)2M(aq)
图涉及的反应可能为N(aq)2M(aq)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据如图判断,下列说法正确的是( )
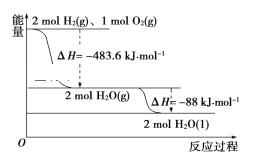
A. 氢气的燃烧热ΔH=-241.8 kJ·mol-1
B. 2 mol H2(g)与1mol O2(g)所具有的总能量比2 mol H2O(g)所具有的总能量低
C. 液态水分解的热化学方程式为2H2O(l)=2H2(g)+O2(g) ΔH=+571.6 kJ·mol-1
D. H2O(g)生成H2O(l)时,断键吸收的能量小于成键放出的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】 lmol碳完全燃烧后可放出393.5KJ的热量,下列热化学方程式正确的是( )
A.C(s)+O2(g)=CO2(g) △H=+393.5kJ/mol
B.C(s)+![]() O2(g)=CO(g) △H=﹣393.5kJ/mol
O2(g)=CO(g) △H=﹣393.5kJ/mol
C.C+O2=CO2 △H=﹣393.5kJ/mol
D.C(s)+O2(g)=CO2(g) △H=﹣393.5kJ/mol
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】我国科学家研发了一种室温下“可呼吸”的Na—CO2二次电池。将NaClO4溶于有机溶剂作为电解液,钠和负载碳纳米管的镍网分别作为电极材料,电池的总反应为:3CO2+4Na![]() 2Na2CO3+C。下列说法错误的是
2Na2CO3+C。下列说法错误的是

A. 放电时,ClO4-向负极移动
B. 充电时释放CO2,放电时吸收CO2
C. 放电时,正极反应为:3CO2+4e =2CO32-+C
D. 充电时,正极反应为:Na++e=Na
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】KIO3是一种重要的无机化合物,可作为食盐中的补碘剂。回答下列问题:
(1)KIO3的化学名称是_______。
(2)利用“KClO3氧化法”制备KIO3工艺流程如下图所示:

“酸化反应”所得产物有KH(IO3)2、Cl2和KCl。“逐Cl2”采用的方法是________。“滤液”中的溶质主要是_______。“调pH”中发生反应的化学方程式为__________。
(3)KIO3也可采用“电解法”制备,装置如图所示。
①写出电解时阴极的电极反应式______。
②电解过程中通过阳离子交换膜的离子主要为_________,其迁移方向是_____________。
③与“电解法”相比,“KClO3氧化法”的主要不足之处有______________(写出一点)。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】溴主要以Br- 形式存在于海水(呈弱碱性)中,利用空气吹出法从海水中提溴,工艺流程示意如下。
![]()
资料:常温下溴呈液态,深红棕色,易挥发。
(1)酸化:将海水酸化的主要目的是避免_______(写离子反应方程式)。
(2)脱氯:除去含溴蒸气中残留的Cl2
①具有脱氯作用的离子是_______。
②溶液失去脱氯作用后,补加FeBr2或加入_______,脱氯作用恢复。
(3)富集、制取Br2:
用Na2CO3溶液吸收溴,Br2歧化为BrO3- 和Br-。再用H2SO4酸化歧化后的溶液得到Br2,其离子反应方程式为_______。
(4)探究(3)中所用H2SO4浓度对Br2生成的影响,实验如下:
序号 | A | B | C |
试剂组成 | 1 mol/L NaBr 20% H2SO4 | 1 mol/L NaBr 98% H2SO4 | 将B中反应后溶液用水稀释 |
实验现象 | 无明显现象 | 溶液呈棕红色,放热 | 溶液颜色变得很浅 |
①B中溶液呈棕红色说明产生了_______。
②分析C中溶液颜色变浅的原因,甲同学认为是发生了化学反应所致;乙同学认为是用水稀释所致。若认为甲同学的分析合理,请用具体的反应说明理由;若认为乙同学的分析合理,进一步设计实验方案说明。理由或方案:_______。
③酸化歧化后的溶液宜选用的酸是______(填“稀硫酸”或“浓硫酸”)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】两种气态烃以任意比例混合,在105℃时1 L该混合烃与9 L氧气混合,充分燃烧后恢复到原状态,所得气体体积仍是10 L。下列各组混合烃中不符合此条件的是 ( )
A.CH4 C2H4B.CH4 C3H4C.C2H4 C3H4D.C2H2 C3H6
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】结合所学内容,回答下列问题:
Ⅰ.某同学进行影响草酸与酸性高锰酸钾溶液反应速率因素的研究。室温下,两支试管分别编号①和②,实验数据如下:
实验序号 | ① | ② | ③ |
加入试剂 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的MnSO4固体 | 4 mL 0.01mol/L酸性 KMnO4溶液 2 mL 0.1mol/L H2C2O4溶液 一粒黄豆粒大的Na2SO4固体 |
褪色时间/s | 116 | 6 |
试管①中KMnO4溶液褪色的速率开始十分缓慢,一段时间后突然加快。
请回答:
(1)草酸与酸性高锰酸钾的反应的离子方程式为:__________________________________
(2)实验①②结论是___________________________________________________________。
(3)实验②选用MnSO4固体而不是MnCl2固体的原因是____________________________。
(4)该同学为使实验更加严密,在试管③中做了如下实验,请预测褪色时间约为________。
Ⅱ.滴定法是一种重要的定量分析方法,应用范围很广。某地市场上销售的一种食用精制盐包装袋上有如下部分说明:
产品等级 | 一级 |
配料 | 食盐、碘酸钾(KIO3)、抗结剂 |
碘含量(以I计) | 20~50 mg·kg-1 |
已知:IO3-+5I-+6H+ = 3I2+3H2O,I2+2S2O32- = 2I-+S4O62-某学生拟测定食用精制盐的碘含量,其步骤为
a.准确称取W g食盐,加适量蒸馏水使其完全溶解
b.用稀硫酸酸化所得溶液,加入足量KI溶液,使KIO3与KI反应完全
c.加入指示剂,逐滴加入物质的量浓度为2.0×10-3 mol·L-1的Na2S2O3溶液10.0 mL,恰好反应完全
(5)c中加入的指示剂可选用_________,恰好完全反应时的现象是_______________。
(6))若操作b在空气中振荡时间过长,则最终测定的测定食用精制盐中的的碘含量会__________(填“偏高”、“偏低”或“没有影响”)。
(7)根据以上实验和包装说明,算得所测食用精制盐的碘含量是(以含W的代数式表示)_____mg·kg-1(计算结果保留整数即可)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com