
【题目】为研究铜与浓硫酸的反应,某化学兴趣小组进行如下实验.
实验I:反应产物的定性探究
按如图装置(固定装置已略去)进行实验

(1)A装置的试管中发生反应的化学方程式是____________;B装置的作用是________E装置中的现象是_______;
(2)实验过程中,能证明无氢气生成的现象是________。
(3)F装置的烧杯中发生反应的离子方程式是_____________________。
实验Ⅱ:反应产物的定量探究
(4)为测定硫酸铜的产率,将该反应所得溶液中和后配制成250.00 mL溶液,取该溶液25.00mL加入足量KI溶液中振荡,生成的I2恰好与20.00 mL 0.30 molL﹣1的Na2S2O3溶液反应,若反应消耗铜的质量为6.4g,则硫酸铜的产率为________。(已知2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣)(注:硫酸铜的产率指的是硫酸铜的实际产量与理论产量的比值)
【答案】Cu+2H2SO4(浓)= CuSO4+SO2↑+2H2O检验是否有水生成褪色D装置中黑色固体颜色无变化SO2+2OH﹣=SO32﹣+H2O60%
【解析】
A为铜和浓硫酸反应,B为检验反应是否有水生成,C为吸收反应生成的水,D为检验反应是否有氢气生成,若有氢气,则固体从黑色变红色,E为检验是否有二氧化硫生成,F为吸收尾气防止污染。(1)铜和浓硫酸反应生成硫酸铜和二氧化硫和水,方程式为: Cu+2H2SO4(浓)![]() CuSO4+SO2↑+2H2O;无水硫酸铜遇水变蓝,所以装置B的作用为检验是否有水生成;E中为品红,根据二氧化硫具有漂白性分析,品红褪色;(2) 若反应中有氢气生成,则与氧化铜反应生成铜,D装置中的固体应从黑色变为红色,该实验中没有氢气生成,所以D装置中黑色固体颜色无变化; (3)F中二氧化硫与氢氧化钠反应生成亚硫酸钠和水,离子方程式为:SO2+2OH﹣=SO32﹣+H2O;(4)根据反应2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣分析得关系式Cu2+---S2O32﹣,20.00 mL0.30 molL﹣1的Na2S2O3溶液中溶质的物质的量为0.30×0.02=0.006mol,则原溶液中铜离子的物质的量为0.06mol,若反应消耗铜的质量为6.4g,即0.1mol,则硫酸铜的产率为0.06/0.1=60%。
CuSO4+SO2↑+2H2O;无水硫酸铜遇水变蓝,所以装置B的作用为检验是否有水生成;E中为品红,根据二氧化硫具有漂白性分析,品红褪色;(2) 若反应中有氢气生成,则与氧化铜反应生成铜,D装置中的固体应从黑色变为红色,该实验中没有氢气生成,所以D装置中黑色固体颜色无变化; (3)F中二氧化硫与氢氧化钠反应生成亚硫酸钠和水,离子方程式为:SO2+2OH﹣=SO32﹣+H2O;(4)根据反应2Cu2++4I﹣=2CuI+I2, 2S2O32﹣+I2=S4O62﹣+2I﹣分析得关系式Cu2+---S2O32﹣,20.00 mL0.30 molL﹣1的Na2S2O3溶液中溶质的物质的量为0.30×0.02=0.006mol,则原溶液中铜离子的物质的量为0.06mol,若反应消耗铜的质量为6.4g,即0.1mol,则硫酸铜的产率为0.06/0.1=60%。


科目:高中化学 来源: 题型:
【题目】铜和硫的化合物在化工、医药材料等领域具有广泛的用途。回答下列问题:
(1)原子轨道是指电子在原子核外的___________,基态S原子的原子轨道数是____个。
(2)基态Cu原子中,核外电子占据的原子轨道为球形的最高能级符号是______,占据该能级的电子数为__________。
(3)Cl、S、Se在元素周期表中处于相邻的位置,其第一电离能的大小顺序为_______。
(4)下图是含元素Cu、S的有机物的结构简式:

①该有机化合物结构中含有的化学键类型是_______(填“共价键““离子键”或“共价键、离子键”)、配位键,其中1个该有机物分子中配位键数为_____个,这些配位键中提供孤电子对的元素是__________。
②S原子的杂化方式为_______、带*N原子的杂化方式为_______。
(5)下图是Cu-Au合金的一种立方晶体结构:

已知该合金的密度分dg/cm3,阿伏加德罗常数的值为NA,若Au原子的半径为bpm(lpm=10-10cm),则铜原子的半径为______cm(写出计算表达式)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化合物AX3和单质X2在一定条件下反应可生成化合物AX5 . 回答下列问题.
(1)已知AX3的熔点和沸点分别为﹣93.6℃和76℃,AX5的熔点为167℃.室温时AX3与气体X2反应生成1mol AX5 , 放出热量123.8kJ.该反应的热化学方程式为 .
(2)反应AX3(g)+X2(g)AX5(g)在容积为10L的密闭容器中进行.起始时AX3和X2均为0.2mol.反应在不同条件下进行,反应体系总压强随时间的变化如图所示.
①下列不能说明反应达到平衡状态的是 .
A.混合气体的平均相对分子质量保持不变
B.混合气体密度保持不变
C.体系中X2的体积分数保持不变
D.每消耗1molAX3同时消耗1molAX5
②计算实验a从反应开始至达到平衡时的反应速率v(AX5)=(保留2位有效数字).
③图中3组实验从反应开始至达到平衡时的反应速率v(AX5)由大到小的次序为 (填实验序号);与实验a相比,其他两组改变的实验条件及判断依据是:b、c . 该反应在实验a和实验c中的化学平衡常数的大小关系是KaKc(填“>、<或=”),其中Kc=(保留小数点后1位).
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】光刻胶是一种应用广泛的光敏材料,其合成路线如下(部分试剂、反应条件和产物已略去):
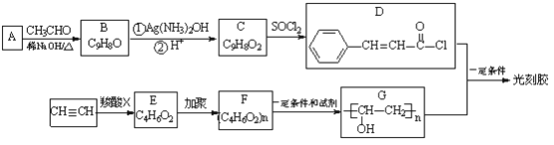
已知:
Ⅰ.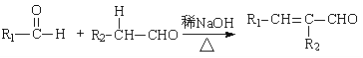 (R,R’为烃基或氢)
(R,R’为烃基或氢)
Ⅱ.![]() (R,R’为烃基)
(R,R’为烃基)
(1)写出A的结构简式__________。
(2)B分子中所含官能团的名称为__________。
(3)乙炔和羧酸X加成生成E,E的核磁共振氢谱为三组峰,且峰面积比为3:2:1,E能发生水解反应,则E![]() F的化学方程式为____________。
F的化学方程式为____________。
(4)由F到G的反应类型为__________。
(5)D和G反应生成光刻胶的化学方程式为__________。
(6)C的一种同分异构体满足下列条件:
①能发生银镜反应,其水解产物之一能与FeCl3溶液发生显色反应
②苯环上的一氧取代产物只有两种。写出该同分异构体的结构简式:_________。
(7)根据已有知识并结合相关信息,写出以CH3CHO为原料制备CH3COCOCOOH的合成路线流程图(无机试剂任用)。合成路线流程图示例如下:
![]() _______________________
_______________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法不正确的是( )
A. 乙酸、乙醇分别和大小相同的金属钠反应,乙酸反应更剧烈
B. 淀粉和纤维素的组成可用(C6H10O5)n 表示,它们互为同分异构体
C. 浓硝酸不慎滴到皮肤上,发现皮肤变黄
D. 苯的结构式虽然用![]() 表示,但苯的结构却不是单、双键交替组成的环状结构,可以从它的邻二氯代物结构只有一种得到证明
表示,但苯的结构却不是单、双键交替组成的环状结构,可以从它的邻二氯代物结构只有一种得到证明
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】向一容积为5L的恒容密闭容器中充入5molA与8molB,在一定条件下反应:2A(g)+3B(g)xC(g)+yD(g) (x、y为正整数),反应进行2min后达到平衡,这2min内平均反应速率v(C)=0.3mol/(Lmin),D的平衡浓度为0.3mol/L,又知v(B):v(C)=3:2,则下列说法中正确的是( )
A.x:y=3:1
B.v(A):v(C)=2:1
C.A的平衡浓度为0.4mol/L
D.A与B的平衡浓度之比为3:2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列涉及化学学科观点的有关说法正确的是![]()
A. 微粒观:二氧化硫是由硫原子和氧原子构成的
B. 转化观:升高温度可以将不饱和硝酸钾溶液转变为饱和
C. 守恒观:1g镁与1g稀硫酸充分反应后所得的溶液质量为2g
D. 结构观:金刚石和石墨由于结构中碳原子的排列方式不同,性质存在着较大的差异
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有硫酸钾K2SO4和硫酸铝Al2(SO4)3的混合溶液,已知其中Al3+的浓度为0.2mol/L,SO42-浓度为0.4mol/L则K+的浓度为( )
A.0. 1mol/LB.0. 2 mol/LC.0. 3 mol/LD.0.4 mol/L
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com