
【题目】纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________。
A.1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
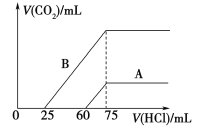
①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________。
【答案】黄 A 32.8% 不同意,由于Ca(OH)2 + 2NaHCO3 = CaCO3↓ + Na2CO3 +2H2O (或Ca(OH)2 + NaHCO3 = CaCO3 ↓+ NaOH +H2O),碳酸氢钠溶液与石灰水反应也能产生白色沉淀 33.6 Na2CO3 与 NaHCO3 1:1
【解析】
(1)考查焰色反应;
(2)根据n=cV,m=nM计算;
(3)根据碳酸氢钠加热分解生成碳酸钠,二氧化碳和水,固体质量的减少即为生成二氧化碳的水的质量;
(4)根据碳酸钠,碳酸氢钠与氢氧化钙的反应判断;
(5)①根据碳原子守恒计算二氧化碳的物质的量即为碳酸氢钠的物质的量,利用n=![]() ;②由曲线B可知从25mL到75mL为碳酸氢钠与盐酸反应生成二氧化碳,根据钠原子守恒计算;
;②由曲线B可知从25mL到75mL为碳酸氢钠与盐酸反应生成二氧化碳,根据钠原子守恒计算;
(1)钠的焰色反应为黄色;
(2)配置950ml的溶液应用1000 mL容量瓶配制溶液,所需Na2CO3的质量m=nM=cVM=0.2mol/L×1L×106g/mol=21.2g,答案选A;
(3)设参加反应的碳酸氢钠的质量为x根据混合物质量减少了2.48g,

![]() ,解得x=6.72g,碳酸钠和碳酸氢钠共10g,则碳酸钠的质量为10g-6.72g= 3.28g,原混合物中碳酸钠的质量分数=
,解得x=6.72g,碳酸钠和碳酸氢钠共10g,则碳酸钠的质量为10g-6.72g= 3.28g,原混合物中碳酸钠的质量分数=![]() =32.8%;
=32.8%;
(4) 由于Ca(OH)2 + 2NaHCO3 = CaCO3↓ + Na2CO3 +2H2O (或Ca(OH)2 + NaHCO3 = CaCO3 ↓+ NaOH +H2O),碳酸钠与氢氧化钙反应会生成碳酸钙沉淀,同样碳酸氢钠与氢氧化钙反应也会生成碳酸钙沉淀,所以不同意他的观点;
(5) ①CO2与NaOH反应为①CO2+NaOH=NaHCO3,②CO2+2NaOH=Na2CO3+H2O,
当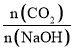 1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成NaHCO3,CO2有剩余;
1,反应按①进行,等于1时,CO2、NaOH恰好反应生成NaHCO3;大于1时,生成NaHCO3,CO2有剩余;
当![]() <
<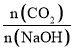 <1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
<1,反应按①②进行,CO2、NaOH反应,无剩余,生成物为NaHCO3、Na2CO3;
当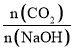
![]() ,反应按②进行,等于
,反应按②进行,等于![]() 时,CO2、NaOH恰好反应生成Na2CO3;小于
时,CO2、NaOH恰好反应生成Na2CO3;小于![]() 时,生成Na2CO3,NaOH有剩余;
时,生成Na2CO3,NaOH有剩余;
由曲线A可知从60ml到75ml为碳酸氢钠与盐酸反应, 消耗的15mL盐酸为碳酸氢钠与盐酸反应并产生CO2,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H2O,所以n(NaHCO3)=n(HCl)=(75ml60ml)×0.1mol/L=1.5×103mol,根据C原子守恒,所以n(CO2)=n(NaHCO3)=1.5×103mol,V= nVm=1.5×103mol×22.4L/mol=33.6 mL;
② 加入75ml盐酸时二氧化碳的体积达最大,此时溶液为氯化钠溶液。根据氯离子、钠离子守恒,所以n(NaOH)=n(NaCl)=n(HCl)=0.075ml×0.1mol/L=0.0075mol,由曲线B可知从25mL到75mL为碳酸氢钠与盐酸反应生成二氧化碳,反应方程式为NaHCO3+HCl=NaCl+CO2↑+H/span>2O,所以n(NaHCO3)=n(HCl)= n(CO2)=(75ml25ml)×0.1mol/L=0.005mol,所以n(CO2):n(NaOH)=0.005mol:0.0075mol=![]() ,大于1:2,小于1,所以反应按①②进行,CO2、NaOH反应,NaOH无剩余,生成物为Na2CO3 与NaHCO3,根据钠原子守恒,所以
,大于1:2,小于1,所以反应按①②进行,CO2、NaOH反应,NaOH无剩余,生成物为Na2CO3 与NaHCO3,根据钠原子守恒,所以![]() n(Na2CO3)+n(NaHCO3)=0.0075mol,而n(NaHCO3)= 0.005mol,则n(NaHCO3)=0.005mol,故Na2CO3 与NaHCO3的物质的量之比为1:1。
n(Na2CO3)+n(NaHCO3)=0.0075mol,而n(NaHCO3)= 0.005mol,则n(NaHCO3)=0.005mol,故Na2CO3 与NaHCO3的物质的量之比为1:1。


 名校练考卷期末冲刺卷系列答案
名校练考卷期末冲刺卷系列答案科目:高中化学 来源: 题型:
【题目】下列有关从海带中提取碘的实验原理和装置能达到实验目的的是

A. 用装置甲灼烧碎海带
B. 用装置乙过滤海带灰的浸泡液
C. 用装置丙制备用于氧化浸泡液中I的Cl2
D. 用装置丁吸收氧化浸泡液中I后的Cl2尾气
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】离子方程式Ba2++SO42-=BaSO4↓可以表示( )
①可溶性钡盐溶液与可溶性硫酸盐溶液之间的反应
②氢氧化钡溶液与可溶性硫酸盐溶液之间的反应
③稀硫酸与可溶性钡盐溶液之间的反应
④氢氧化钡溶液与稀硫酸之间的反应
A.①B.①②④C.②③D.①②③
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知:浓硫酸易使有机物脱水,如图是用实验室制得的乙烯(C2H5OH![]() CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是
CH2=CH2↑+H2O)与溴水作用制取1,2-二溴乙烷的部分装置图,根据图示判断下列说法正确的是

A. 装置①和装置③中都盛有水,其作用相同
B. 装置②和装置④中都盛有NaOH溶液,其吸收的杂质相同
C. 产物可用分液的方法进行分离,1,2-二溴乙烷应从分液漏斗的上口倒出
D. 制备乙烯时温度计水银球位置应在反应液的液面下
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为( )

A.4∶3B.1∶3C.1∶4D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】“垃圾是放错了位置的资源”,应该分类回收。某化学兴趣小组拟采用如下处理方法回收废电池中的资源。
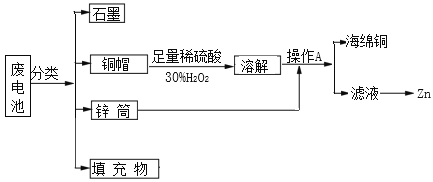
(1)碱性锌锰干电池的电解质为KOH,总反应为Zn+2MnO2+2H2O═2MnOOH+ Zn(OH)2,其正极的电极反应式为_________。
(2)铜帽溶解时加入H2O2的目的是___________________ (用化学方程式表示)。铜帽溶解完全后,可采用________ 方法除去溶液中过量的H2O2。
(3)填充物中可以回收得到氯化铵,写出氯化铵溶液中各离子浓度的大小顺序______。
(4)铜器在潮湿环境中发生的电化学腐蚀如图所示:
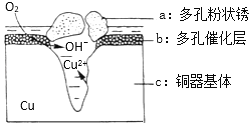
环境中的Cl﹣扩散到孔口,并与正极反应产物和负极产物作用生成多孔粉状锈Cu2(OH)3Cl,其若生成4.29g Cu2(OH)3Cl,则理论上消耗氧气体积为______L(标准状况)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.原子核外电子排布式为1s2的原子与原子核外电子排布式为1s22s2的原子化学性质相似
B.Fe3+的最外层电子排布式为3s23p63d5
C.基态铜原子价电子的轨道表示式: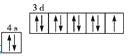
D.基态碳原子价电子的轨道表示式:
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
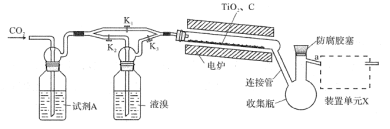
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com