
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为( )

A.4∶3B.1∶3C.1∶4D.2∶3
【答案】D
【解析】
首先写出发生镁离子和铝离子与氢氧根反应的离子方程式,然后发生反应氢氧化铝的溶解,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的物质的量为0.1mol,根据离子方程式,可知沉淀Al3+消耗的氢氧化钠溶液的物质的量,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液0.5mol,计算沉淀Mg2+消耗的氢氧化钠溶液的物质的量,据此确定溶液中SO42-与Cl-的物质的量之比。
首先发生反应Mg2++2OH═Mg(OH)2↓、Al3++3OH═Al(OH)3↓,然后发生反应Al(OH)3+OH═AlO2+2H2O,由图可知,溶解Al(OH)3消耗氢氧化钠溶液的物质的量为0.1mol,根据离子方程式Al3++3OH═Al(OH)3↓可知,沉淀Al3+消耗的氢氧化钠溶液的物质的量为0.1mol×3=0.3mol,沉淀Mg2+、Al3+总共消耗氢氧化钠溶液0.4mol,则沉淀Mg2+消耗的氢氧化钠溶液的物质的量为0.4mol0.3mol=0.1mol,Mg2++2OH═Mg(OH)2↓、Al3++3OH═Al(OH)3↓,则n(Mg2+):n(Al3+)=![]() :
:![]() =1:2,根据MgCl2和Al2(SO4)3的化学式,故Cl与SO42的物质的量之比为:1×2:2×
=1:2,根据MgCl2和Al2(SO4)3的化学式,故Cl与SO42的物质的量之比为:1×2:2×![]() =2:3,
=2:3,
答案选D。


 课课通课程标准思维方法与能力训练系列答案
课课通课程标准思维方法与能力训练系列答案科目:高中化学 来源: 题型:
【题目】某混合物A含有KAl(SO4)2、Al2O3和Fe2O3,在一定条件下可实现下图所示的物质之间的变化:

据此回答下列问题:
(1)I、II、III、IV四步中对于溶液和沉淀的分离采取的方法是____________。
(2)根据上述框图反应关系,写出下列B、D、E所含物质的化学式
固体B_________________;沉淀D __________________;
溶液E_________________________________________。
(3)写出①、④两个反应的化学方程式
①__________________________________;④_____________________________。
(4)写出②、③两个反应的离子方程式
②_________________________________;③______________________________。
(5)设计实验检验溶液F中所含溶质:______________________________________
(6)分别写出Al2O3和Fe2O3在工业上的一种主要用途:
Al2O3__________________________Fe2O3____________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列变化不可能通过一步反应直接完成的是
A. Al(OH)3 → Al2O3 B. Al2O3 → Al(OH)3
C. Al → AlO2- D. Al3+ → Al(OH)3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列事实不能用勒夏特列原理解释的是( )
A.对于2HI(g)![]() H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
H2(g)+ I2(g),达平衡后,缩小容器体积可使体系颜色变深
B.合成氨反应中为提高氨的产率,理论上应采取降低温度的措施
C.实验室配制FeCl3溶液时,将FeCl3固体加入到少量的浓盐酸中再加水稀释
D.用饱和食盐水可以去除Cl2中的HCl
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,草酸(H2C2O4)的Ka1=5.4×10-2,Ka2=5.4×10-5,是一种常用的除锈剂。0.1mol/L的NaHC2O4溶液中,下列粒子的物质的量浓度关系不正确的是( )
A.c(Na+)+ c(H+)= c(HC2O4-)+2 c(C2O42-)+ c(OH-)
B. c(Na+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4)
C. c(Na+)>c(HC2O4-)>c(OH-)>c(H2C2O4)>c(H+)
D. c(H+)+ c(H2C2O4)= c(OH-)+ c(C2O42-)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】纯碱和小苏打都是重要的化工原料,在生产和生活中有着广泛的应用。
(1)用洁净的铂丝蘸取Na2CO3溶液置于酒精灯火焰上灼烧,火焰呈__________色。
(2)实验室中需0.2mol/L的Na2CO3溶液950mL,配制时应选用容量瓶的规格和称取Na2CO3的质量分别是__________。
A.1000mL;21.2g B.950mL;20.14g C.500mL;21.2g D.500mL;10.6g
(3)若加热10.00g的碳酸钠和碳酸氢钠的混合物,使碳酸氢钠完全分解,混合物质量减少了2.48g,则原混合物中碳酸钠的质量分数为______。
(4)某同学为确定一包可能由碳酸钠和碳酸氢钠组成的白色混合物的成分,他取少量该白色物质溶于水,并向所得溶液中加入适量澄清石灰水,产生白色沉淀,据此该同学认为有碳酸钠。你是否同意该同学的观点,请你用适当的化学方程式阐述你的观点________。
(5)取等物质的量浓度的NaOH溶液两份A和B,每份10 mL,分别向A、B中通入不等量的CO2,再继续向两溶液中逐滴加入0.1 mol/L的盐酸,标准状况下产生的CO2的体积与所加盐酸体积之间的关系如图所示,试回答下列问题:
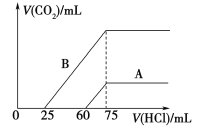
①曲线A表明,原NaOH溶液中通入CO2后,所得溶液加盐酸后产生CO2气体体积(标准状况)的最大值为_______mL。
②曲线B表明,原NaOH溶液中通入CO2后,所得溶液中的溶质成分是________,其物质的量之比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】实验室可用二氧化锰跟浓盐酸反应制备并收集干燥纯净的氯气。进行此实验,所用仪器如图:
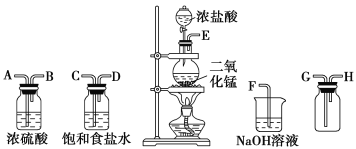
(1)连接上述仪器的正确顺序(填各接口处的字母):________接________;________接________;________接________;________接________。
(2)装置中,饱和食盐水的作用是__________;用湿润的淀粉KI试纸可检验是否有Cl2产生。若有Cl2产生,可观察到的现象是___________。
(3)写出该实验中气体发生装置中进行的反应的离子方程式________。有兴趣小组将实验制得的氯气通入热的KOH溶液,得到了KClO3,写出该反应的化学方程式______。
(4)该兴趣小组为比较Fe2+与I-还原性的强弱,向FeI2溶液中通入少量氯气,再向其中加入__________(填试剂化学式),充分振荡,下层溶液呈紫红色。已知氧化性Cl2强于Fe3+,请写出向FeI2溶液中通入过量氯气反应的离子方程式_________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有四种不同堆积方式的金属晶体的晶胞如图所示,有关说法正确的是( )

A. ①为简单立方堆积 ②为六方最密堆积 ③为体心立方堆积 ④为面心立方最密堆积
B. 每个晶胞含有的原子数分别为:①1个,②2个,③2个,④4个
C. 晶胞中原子的配位数分别为:①6,②8,③8,④12
D. 空间利用率的大小关系为:①<②<③<④
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。
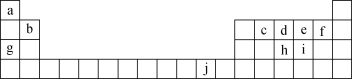
回答下列问题:
(1)写出元素f的基态原子核外电子排布式:__。
(2)写出元素h的基态原子核外电子轨道表示式:__。
(3)ci2分子的电子式为__。
(4)第一电离能:h__(填“>”“<”或“=”,下同)i;电负性:g__b。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的叙述正确的是__(填字母)。
A.j位于元素周期表中第4周期ⅠB族,属于ds区元素
B.d的基态原子中,2p轨道为半充满,属于p区元素
C.最外层电子排布式为4s1,该元素一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是第ⅢA族或ⅢB族
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com