
【题目】下表为元素周期表的一部分,表中所列的字母分别代表一种化学元素。
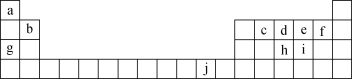
回答下列问题:
(1)写出元素f的基态原子核外电子排布式:__。
(2)写出元素h的基态原子核外电子轨道表示式:__。
(3)ci2分子的电子式为__。
(4)第一电离能:h__(填“>”“<”或“=”,下同)i;电负性:g__b。
(5)下列关于元素在元素周期表中的位置以及元素原子的外围电子排布特点的叙述正确的是__(填字母)。
A.j位于元素周期表中第4周期ⅠB族,属于ds区元素
B.d的基态原子中,2p轨道为半充满,属于p区元素
C.最外层电子排布式为4s1,该元素一定属于第ⅠA族
D.最外层电子排布式为ns2np1,该元素可能是第ⅢA族或ⅢB族
【答案】1s22s22p5 ![]()
![]() > < AB
> < AB
【解析】
根据元素在周期表中的位置可知,a为H元素、b为Be元素、c为C元素、d为N元素、e为O元素、f为F元素、g为Na元素、h为P元素、i为S元素、j为Cu元素,结合原子结构和元素周期律分析解答。
根据元素在周期表中的位置可知,a为H元素、b为Be元素、c为C元素、d为N元素、e为O元素、f为F元素、g为Na元素、h为P元素、i为S元素、j为Cu元素。
(1)f为F元素,原子核外电子数目为9,核外电子排布式为1s22s22p5,故答案为:1s22s22p5;
(2)元素h为P,为15号元素,基态原子核外电子轨道表示式为![]() ,故答案为:
,故答案为:![]() ;
;
(3)ci2分子CS2,与二氧化碳的结构类似,电子式为![]() ,故答案为:
,故答案为:![]() ;
;
(4)P元素的3p能级为半满稳定状态,较稳定,故第一电离能P>S;金属性越强,电负性越小,故电负性Na<Be,故答案为:>,<;
(5)A.j是Cu元素位于元素周期表中第四周期、ⅠB族,价电子排布式为3d104s1,属于ds区元素,故A正确;B.N原子的基态原子中2p能级为半充满,属于p区元素,故B正确;C.最外层电子排布式为4s1,可能处于ⅠA族、ⅠB族、ⅥB族,故C错误;D.最外层电子排布式为ns2np1,该元素处于第ⅢA族,故D错误;故答案为:AB。


 名师指导期末冲刺卷系列答案
名师指导期末冲刺卷系列答案 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为( )

A.4∶3B.1∶3C.1∶4D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)标准状况下,4.48 L NH3所含分子数为____________。___molCO2中含有氧原子数与1.806×1024个H2O分子含有的氧原子数相同
(2) 1.7g H2O2中含有氧原子的物质的量为 _________mol,电子数目为 _____,已知ag H2O2中含原子数为b,则阿伏伽德罗常数为 _________(用含a、b的代数式表示)
(3)8.4 g N2与9.6 g某单质Rx,所含原子个数相同,且分子数之比为3:2,则R的相对原子质量是_______,x值为_______。并写出R原子的原子结构示意图_________
(4)标况下等质量的O2与O3的体积之比为 ______,氧原子个数之比为 ______。
(5)在一密闭容器中充入a molNO和b molO2,可发生如下反应 2NO+O2=2NO2,充分反应后容器中氮原子和氧原子的个数之比__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】利用小粒径零价铁(ZVI)的电化学腐蚀处理三氯乙烯,进行水体修复的过程如图所示。H+,O2,NO3-等共存物的存在会影响水体修复效果,定义单位时间内ZVI释放电子的物质的量为nt,其中用于有效腐蚀的电子的物质的量为ne。下列说法错误的是( )

A. 反应①②③④均在正极发生
B. 单位时间内,三氯乙烯脱去amolCl时ne=amol
C. ④的电极反应式为NO3-+10H++8e-=NH4++3H2O
D. 增大单位体积水体中小粒径ZVI的投入量,可使nt增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.10mol·L-1的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
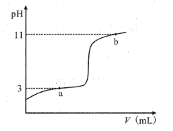
A. a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B. 溶液在a点和b点时水的电离程度相同
C. b点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D. V=10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】四溴化钛(TiBr4)可用作橡胶工业中烯烃聚合反应的催化剂。已知TiBr4常温下为橙黄色固体,熔点为38.3℃,沸点为233.5℃,具有潮解性且易发生水解。实验室利用反应TiO2+C+2Br2![]() TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
TiBr4+CO2制备TiBr4的装置如图所示。回答下列问题:
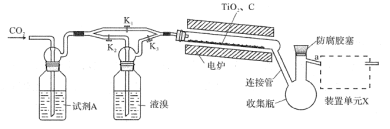
(1)检查装置气密性并加入药品后,加热前应进行的操作是__,其目的是__,此时活塞K1,K2,K3的状态为__;一段时间后,打开电炉并加热反应管,此时活塞K1,K2,K3的状态为____。
(2)试剂A为__,装置单元X的作用是__;反应过程中需用热源间歇性微热连接管,其目的是___。
(3)反应结束后应继续通入一段时间CO2,主要目的是___。
(4)将连接管切断并熔封,采用蒸馏法提纯。此时应将a端的仪器改装为__、承接管和接收瓶,在防腐胶塞上加装的仪器是___(填仪器名称)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某酸件废水可能含有Fe2+、Fe3+、Al3+、Mg2+、Na+、K+、CO32-、SO42-。取废水祥品分别进行如图所示①~④四个实验。下列推断正确的是

A. 废水含有Na+,不含K+
B. 废水含有SO42-和CO32-
C. 废水不含Fe3+,可能含Fe2+
D. 废水一定含有Na+、Al3+、SO42-
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列关于反应与能量的说法正确的是( )
A.Zn(s)+CuSO4(aq)=ZnSO4(aq)+Cu(s) ΔH=-216kJ·mol-1,E反应物<E生成物
B.CaCO3(s)=CaO(s)+CO2(g) ΔH=+178.2kJ·mol-1,E反应物<E生成物
C.2HCl(g)=H2(g)+Cl2(s) ΔH=+92.3kJmol-1,1molHCl在密闭容器中分解后放出92.3kJ的能量
D.将0.5molN2和1.5molH2置于密闭的容器中充分反应后生成NH3(g),放热19.3kJ,其热化学方程式为N2(g)+3H2(g)![]() 2NH3(g) ΔH=-38.6kJ·mol-1
2NH3(g) ΔH=-38.6kJ·mol-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】苹果酸的结构简式为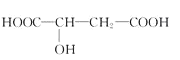 苹果酸可能发生的反应是( )
苹果酸可能发生的反应是( )
①与NaOH溶液反应;②与石蕊试液作用变红;③与金属钠反应放出气体;
④一定条件下与乙酸酯化;⑤一定条件下与乙醇酯化:
A.①②③B.①②③④C.①②③⑤D.①②③④⑤
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com