
【题目】25℃时,草酸(H2C2O4)的Ka1=5.4×10-2,Ka2=5.4×10-5,是一种常用的除锈剂。0.1mol/L的NaHC2O4溶液中,下列粒子的物质的量浓度关系不正确的是( )
A.c(Na+)+ c(H+)= c(HC2O4-)+2 c(C2O42-)+ c(OH-)
B. c(Na+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4)
C. c(Na+)>c(HC2O4-)>c(OH-)>c(H2C2O4)>c(H+)
D. c(H+)+ c(H2C2O4)= c(OH-)+ c(C2O42-)
【答案】C
【解析】
草酸(H2C2O4)的Ka2=5.4×10-5,则C2O42-的水解常数Kh1=![]() =1.9×10-10,Ka2> Kh1,所以HC2O4-在溶液中以电离为主。在NaHC2O4溶液中,存在以下电离或水解:NaHC2O4=Na++ HC2O4-,HC2O4-
=1.9×10-10,Ka2> Kh1,所以HC2O4-在溶液中以电离为主。在NaHC2O4溶液中,存在以下电离或水解:NaHC2O4=Na++ HC2O4-,HC2O4- ![]() C2O42-+H+,HC2O4-+H2O
C2O42-+H+,HC2O4-+H2O![]() H2C2O4+OH-,H2O
H2C2O4+OH-,H2O![]() H++OH-。
H++OH-。
A.依据电荷守恒,c(Na+)+ c(H+)= c(HC2O4-)+2c(C2O42-)+ c(OH-),A正确;
B.依据物料守恒,在NaHC2O4中,c(Na+)= c(C2O42-)+ c(HC2O4-)+ c(H2C2O4),B正确;
C.由于HC2O4-在溶液中以电离为主,所以溶液显酸性,c(OH-)<c(H+),C不正确;
D.由HC2O4- ![]() C2O42-+H+,HC2O4-+H2O
C2O42-+H+,HC2O4-+H2O![]() H2C2O4+OH-,H2O
H2C2O4+OH-,H2O![]() H++OH-可以得出,c(H+)+ c(H2C2O4)= c(OH-)+ c(C2O42-),D正确;
H++OH-可以得出,c(H+)+ c(H2C2O4)= c(OH-)+ c(C2O42-),D正确;
故选C。


科目:高中化学 来源: 题型:
【题目】下列实验现象与实验操作不相匹配的是
实验操作 | 实验现象 | |
A | 向盛有高锰酸钾酸性溶液的试管中通入足量的乙烯后静置 | 溶液的紫色逐渐褪去,静置后溶液分层 |
B | 将镁条点燃后迅速伸入集满CO2的集气瓶 | 集气瓶中产生浓烟并有黑色颗粒产生 |
C | 向盛有饱和硫代硫酸钠溶液的试管中滴加稀盐酸 | 有刺激性气味气体产生,溶液变浑浊 |
D | 向盛有FeCl3溶液的试管中加过量铁粉,充分振荡后加1滴KSCN溶液 | 黄色逐渐消失,加KSCN后溶液颜色不变 |
A. AB. BC. CD. D
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知溶液中可发生反应:2FeBr2+Br2=2FeBr3,现向100mL的FeBr2溶液中通入3.36LCl2(标准状况),充分反应后测得溶液中Cl-和Br-的物质的量浓度相等,则原FeBr2溶液的物质的量浓度为( )
A. 2molL-1 B. 1molL-1 C. 0.4molL-1 D. 0.2molL-1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】聚乙炔衍生物分子M的结构简式及M在稀硫酸作用下的水解反应如图所示。下列有关说法不正确的是( )

A.M与A均能使酸性高锰酸钾溶液和溴水褪色
B.1molM与热的烧碱溶液反应,可消耗2molNaOH
C.B、C均能发生消去反应和酯化反应
D.A、B、C各1mol分别与金属钠反应,放出气体的物质的量之比为1∶2∶2
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业制硫酸工艺的催化氧化反应原理是:2SO2(g)+O2(g)![]() 2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
2SO3(g)ΔH<0,起始以相同的物质的量进行投料,测得SO2在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
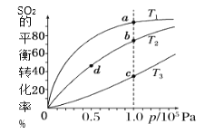
A.温度:T1温度最高
B.正反应速率:υ(a)>υ(b)=υ(d)>υ(c)
C.平均摩尔质量:M(a)<M(b)= M(d)<M(c)
D.平衡常数:K(a)>K(b)=K(d)>K(c)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有MgCl2和Al2(SO4)3的混合溶液,向其中逐滴加入NaOH溶液,得到沉淀的物质的量与加入NaOH的物质的量关系如图所示,则原溶液中Cl-与SO42-的物质的量之比为( )

A.4∶3B.1∶3C.1∶4D.2∶3
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】能源问题是现代社会发展的三大基本问题之一。
(1)焦炭可用于制取水煤气。实验测得1.2 g 碳与水蒸气完全反应生成水煤气时,吸收了13.16 kJ热量。该反应的热化学方程式为______________;该反应在________条件下能自发进行(选“高温”、“低温”或“任意温度”)。
(2)甲醇(CH3OH)广泛用作燃料电池的燃料,工业上可由CO和H2来合成,化学方程式为CO(g)+2H2(g)![]() CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
CH3OH(g)。如图是在不同温度下CO的转化率随时间变化的曲线。
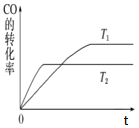
①T1和T2温度下的平衡常数大小关系是K1________(填“>”、“<”或“=”)K2。
②若容器容积不变,下列措施不能增加CO转化率的是________(填字母)。
a.降低温度
b.将CH3OH(g)从体系中分离
c.使用合适的催化剂
③生成甲醇的化学反应速率(v)与时间(t)的关系如图所示。则图中t2时采取的措施可能是_____;
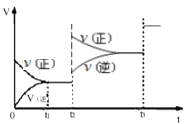
④若在T1℃时,往一密闭容器通入等物质的量CO和H2测得容器内总压强1MPa,40min达平衡时测得容器内总压强为0.6MPa,计算生成甲醇的压强平衡常数KP=________(MPa)-2(小数点后保留2位小数,用平衡分压代替平衡浓度计算,分压=总压×物质的量分数)。
(3)甲醇(CH3OH)燃料电池是以铂为电极,以KOH溶液为电解质溶液,在两极区分别加入CH3OH和O2即可产生电流。请写出负极的电极反应为_______________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是碳和碳的化合物的转化关系:C![]() CO2
CO2![]() H2CO3
H2CO3![]() CaCO3
CaCO3![]() CO2。其各步转化的基本反应类型从左到右依次是( )。
CO2。其各步转化的基本反应类型从左到右依次是( )。
A.化合、分解、置换、复分解B.置换、化合、复分解、分解
C.复分解、化合、分解、置换D.分解、置换、化合、复分解
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】25℃时,向10mL0.10mol·L-1的一元弱酸HA(Ka=1.0×10-3)中逐滴加入0.10mol·L-1NaOH溶液,溶液pH随加入NaOH溶液体积的变化关系如图所示。下列说法正确的是( )
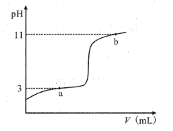
A. a点时,c(HA)+c(OH-)=c(Na+)+c(H+)
B. 溶液在a点和b点时水的电离程度相同
C. b点时,c(Na+)=c(HA)+c(A-)+c(OH-)
D. V=10mL时,c(Na+)>c(A-)>c(H+)>c(HA)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com