
【题目】化学与人类生活、社会可持续发展密切相关。下列变化不属于化学研究范畴的是( )
A. MERS病毒疫苗的研制 B. 朝鲜的原子弹爆炸实验
C. 近期出现雾霾的原因探究 D. 马鞍山钢铁厂冶炼铁
 课时训练江苏人民出版社系列答案
课时训练江苏人民出版社系列答案科目:高中化学 来源: 题型:
【题目】某溶液中可能含有Na+、Al3+、Fe3+、NO3-、SO42-、Cl-,滴入过量氨水,产生白色沉淀,若溶液中各离子的物质的量浓度相等,则一定存在的离子是
A. SO42- B. NO3- C. Na+ D. Fe3+
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(双选)![]() g铜与足量浓H2SO4共热时完全反应,在标准状况下生成
g铜与足量浓H2SO4共热时完全反应,在标准状况下生成![]() L气体,则被还原的H2SO4的量是( BC )
L气体,则被还原的H2SO4的量是( BC )
A. ![]() mol B.
mol B. ![]() mol C.
mol C. ![]() g D.
g D. ![]() g
g
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】将某些化学知识用数轴表示,可以收到直观、简明、易记的效果。用数轴表示的下列知识正确的是( )
A. 硫及其化合物的化合价与氧化还原反应的关系:
B. 分散系的分类:
C. AlCl3溶液与NaOH溶液反应后铝元素的存在形式:
D. CO2与NaOH溶液反应后的产物
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】M、R、X、Y为原子序数依次增大的短周期主族元素,Z是一种过渡元素。M基态原子L层中p 轨道电子数是s轨道电子数的2倍,R是同周期元素中最活泼的金属元素,X和M形成的一种化合物是引起酸雨的主要大气污染物,Z的基态原子4s和3d轨道半充满。
据此请回答下列问题:
(1)R基态原子的电子排布式是 ,X和Y中电负性较大的是 (填元素符号)。
(2)X的氢化物的沸点低于与其组成相似的M的氢化物,其原因是 。
(3)X与M形成的XM3分子的空间构型是 。
(4)M和R所形成的一种离子化合物R2M晶体的晶胞如右图所示,则图中黑球代表的离子是 (填离子符号)。

(5)在稀硫酸中,Z的最高价含氧酸的钾盐(橙色)氧化M的一种氢化物,Z被还原为+3价,该反应的化学方程式是 。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(10分)铁砂的主要成分是微粒状的磁性氧化铁、石英、石灰石等混合物。某化学兴趣小组从铁砂中分离出磁性氧化铁,并进行铝热反应实验。
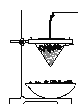
(1)取磁性氧化铁按图装置进行铝热反应,引发铝热反应的实验操作是______________,
现象很壮观,取少许反应生成的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种结果的原因,除了可能混有没反应的磁性氧化铁外,还有一个原因是 。
(2)设计一个简单的实验方案,证明上述所得的“铁块”中含有金属铝。该实验所用试剂是_________,反应的离子方程式为___________________________________________。
(3)请写出此铝热反应的化学方程式: 。
每摩铝参与反应,转移的电子数为 。
(4)生成除磁性氧化铁可做铝热反应实验外,下列哪些试剂也可以________。
A.CuO B.Na2O2 C.MnO2 D.MgO
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】分别向盛有①紫色石蕊溶液 ②NaOH溶液 ③品红溶液 ④酸性高锰酸钾溶液的试管中通入SO2气体。
(1)试管①中的现象:___________发生反应的化学方程式是:_________________。
(2)试管②中发生反应的化学方程式是:_____________________,如果通入过量的SO2,则发生反应的化学方程式为:_______________________________。
(3)试管③中的现象:________,如将吸收SO2后的该溶液加热,现象:______________。
(4)试管④中的现象:____________________。
(5)上述实验中,SO2表现出酸性氧化物性质的是___________(填试管标号,下同),SO2表现出漂白性的是___________。SO2表现出还原性的是___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】几种含硅元素的物质之间的相互转化关系如图所示:

(1)写出图示反应的几种物质的化学式:B________,C________,D________。
(2)写出下列反应的化学方程式:①B→A:______________________________;
②B→E:_____________________________________________________。
(3)写出下列溶液中反应的离子方程式:D→C___________________________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】用HCl的质量分数为36.5%的浓盐酸(密度为1.20g/cm3) 配置1L 1mol/L的稀盐酸。回答下列有关问题。完成下述操作步骤:
(1)计算:需量取36.5%的浓盐酸的体积为________毫升。
(2)量取:用量筒量取所需浓盐酸并注入到250mL烧杯中;
(3)溶解:___________________________________________________并冷却。
(4)转移(移液):_________________________________________________。
(5)洗涤:__________________________________________________________。
(6)定容:__________________________________________________________。
(7)摇匀:盖好容量瓶塞,反复颠倒、摇匀;
(8)储藏:将配置好的稀盐酸倒入试剂瓶中,并贴好标签。标签上要注明______________。
(9)误差分析:以下操作造成配得的盐酸浓度是“偏高”、“相等”还是“偏低”?
①用量筒量取浓盐酸后,用蒸馏水洗涤筒量后的溶液转入容量瓶中;____________。
②容量瓶中有少量的蒸馏水;__________________。
③没有将洗涤烧杯和玻璃棒的溶液转入容量瓶中;___________。
④定容读数时,府视容量瓶的刻度线;________________。
⑤定容摇匀后发现容量瓶中液面低于刻度线,又加水;________________。
⑥未冷却就转移定容;_____________________。
⑦润洗了容量瓶;_______________。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com