
【题目】常温下,向20.00mL0.1000molL﹣1(NH4)2SO4溶液中逐滴加入0.2000molL﹣1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( ) 
A.点a所示溶液中:c(NH4+)>c(SO42﹣)>c(OH﹣)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH﹣)
C.点c所示溶液中:c(SO42﹣)+c(H+)=c(NH3H2O)+c(OH﹣)
D.点d所示溶液中:c(SO42﹣)>c(NH3H2O)>c(NH4+)>c(OH﹣)
【答案】C
【解析】解:A.a点溶液中,铵根离子水解导致溶液呈酸性,即c(H+)>c(OH﹣),铵根离子水解程度较小,结合物料守恒知c(NH4+)>c(SO42﹣),所以溶液中离子浓度大小顺序是c(NH4+)>c(SO42﹣)>c(H+)>c(OH﹣),故A错误;B.b点溶液中,溶液呈中性,则c(H+)=c(OH﹣),根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42﹣)+c(OH﹣),硫酸铵的酸性较弱,要使混合溶液呈中性,则加入少量氢氧化钠即可,所以c(NH4+)>c(Na+),故B错误;
C.c点溶液中,溶液呈碱性,所以c(H+)<c(OH﹣),溶液中的溶质是等物质的量浓度的硫酸铵、硫酸钠、一水合氨,根据电荷守恒得c(H+)+c(NH4+)+c(Na+)=2c(SO42﹣)+c(OH﹣),根据物料守恒得,根据物料守恒得c(NH4+)+c(NH3H2O)=2c(SO42﹣)=2c(Na+),所以得c(SO42﹣)+c(H+)=c(NH3H2O )+c(OH﹣),故C正确;
D.d点溶液中,二者恰好反应生成硫酸钠、一水合氨,且硫酸钠是氨水浓度的一半,一水合氨电离程度较小,所以c(NH3H2O )>c(SO42﹣),故D错误;
故选C.


科目:高中化学 来源: 题型:
【题目】短周期主族元素x、y、z在元素周期表中的相对位置如图,下列推论合理的是( ) 
A.若y和z能形成化合物,则x为氮元素
B.若x、y、z的单质常温下都是气体,则Y为氧元素
C.若x、y、z是非金属元素,则它们气态氢化物的水溶液都显酸性
D.若x、y、z的原子序数之和小于20,则它们都是金属元素
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 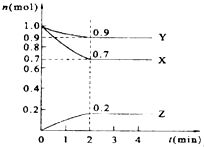
(1)Y的转化率是 .
(2)由图中所给数据进行分析,该反应的化学方程为;
(3)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为 .
(4)当反应进行到第min,该反应达到平衡.
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某可逆反应过程的能量变化如图所示,下列说法正确的是( ) 
A.该反应能量变化类型与CaCO3分解反应相同
B.加催化剂后,正反应速率加快,逆反应速率减小
C.若该反应为氧化还原反应,则可以将其设计成原电池
D.反应热△H=E2﹣E1
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】依据元素周期表及元素周期律,下列推断正确的是
A. HCl、HBr、HI的热稳定性依次增强
B. 若M+和R2-的核外电子层结构相同,则原子序数:R>M
C. 同主族元素从上到下,单质的熔点逐渐降低
D. 同周期元素(除0族元素外)从左到右,原子半径逐渐减小
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】如图是在航天用高压氢镍电池基础上发展起来的一种金属氢化物镍电池(MH﹣Ni电池),下列有关说法中不正确的是( )
A.放电时正极反应为:NiOOH+H2O+e﹣→Ni(OH)2+OH﹣
B.电池的电解液可为KOH溶液
C.充电时负极反应为:MH+OH﹣→H2O+M+e﹣
D.MH是一类储氢材料,其氢密度越大,电池的能量密度越高
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】CH3COOH分别跟H﹣18O﹣C2H5和H﹣16O﹣C2H5酯化反应后,两者生成的水分子的相对分子质量( )
A.前者大
B.前者小
C.相等
D.不能确定
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】把镁条投入到盛有盐酸的敞口容器中,产生H2的速率可由下图表示.在下列因素中对产生H2速率没有影响的是( ) 
A.H+的浓度
B.镁条的表面积
C.溶液的温度
D.Cl﹣的浓度
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com