
【题目】某温度时,在2L的密闭容器中,X、Y、Z三种物质的量随时间的变化曲线如图所示. 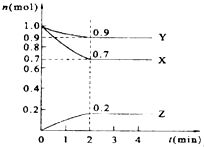
(1)Y的转化率是 .
(2)由图中所给数据进行分析,该反应的化学方程为;
(3)反应从开始至2分钟末,用X的浓度变化表示的平均反应速率为 .
(4)当反应进行到第min,该反应达到平衡.
【答案】
(1)10%
(2)3X+Y?2Z
(3)0.00125mol/(L?s)
(4)2
【解析】解:(1)根据转化率= ![]() ×100%=
×100%= ![]() ×100%=10%,所以答案是:10%;(2)由图像可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为3X+Y2Z,所以答案是:3X+Y2Z;(3)v(X)=
×100%=10%,所以答案是:10%;(2)由图像可以看出,反应中X、Y的物质的量减小,Z的物质的量增多,则X、Y为反应物,Z为生成物,且△n(X):△n(Y):△n(Z)=0.3mol:0.1mol:0.2mol=3:1:2,则反应的化学方程式为3X+Y2Z,所以答案是:3X+Y2Z;(3)v(X)= ![]() =0.075mol(Lmin)﹣1=0.00125mol/(Ls),所以答案是:0.00125mol/(Ls);(4)根据图像可知,当在2mim时,反应中各组份的物质的量不再随时间变化而变化,此时反应达到平衡状态,所以答案是:2.
=0.075mol(Lmin)﹣1=0.00125mol/(Ls),所以答案是:0.00125mol/(Ls);(4)根据图像可知,当在2mim时,反应中各组份的物质的量不再随时间变化而变化,此时反应达到平衡状态,所以答案是:2.


 口算能手系列答案
口算能手系列答案科目:高中化学 来源: 题型:
【题目】化学与生产、生活密切联系。下列物质的用途与其化学性质无关的是
A. 干冰用于舞台制作云海美景 B. 小苏打用于做馒头时的发酵剂
C. 还原铁粉用于月饼盒内的除氧剂 D. 生石灰用于某些食品袋内的干燥剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A.石油裂化的主要目的是为了提高轻质油的质量和产量
B.石油分馏所得到的馏分是一种具有固定熔沸点的纯净物
C.可燃冰、干冰和冰的主要化学成分相同
D.石油的裂化、分馏、裂解等都是化学变化
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】化学能与热能、电能等能相互转化.关于化学能与其他能量相互转化的说法正确的是( ) 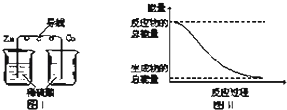
A.中和反应中,反应物的总能量比生成物的总能量低
B.图I所示的装置能将化学能转变为电能
C.化学反应中能量变化的主要原因是化学键的断裂与生成
D.图Ⅱ所示的反应为吸热反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以石油裂解产物烯烃为原料合成一些新物质的路线如下. 
已知: ![]() +
+![]()
![]()
![]()
完成下列填空:
(1)B与乙烯发生反应的类型是 , 甲的结构简式为 .
(2)写出A→B的化学方程式 .
(3)写出符合下列条件的W的一种同分异构体的结构简式 .
①遇FeCl3溶液显紫色,但不能与浓溴水反应;
②1H﹣NMR谱显示有四种不同化学环境的氢原子.
(4)下列说法不正确的是(填选项字母).
A.化合物A,C均能使酸性KMnO4溶液褪色
B.1molW生成1molR仅需要2mol的H2
C.化合物Y属于酯类的同分异构体有4种
D.化合物R分子式为C9H18O2
(5)写出上图中B到C的合成路线(无机试剂任选) . (合成路线常用的表示方式为:A ![]() B
B ![]() …目标产物)
…目标产物)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是( ) 
A.构成原电池的两个电极必须是活泼性不同的两种金属
B.右图原电池中,电流由锌棒经外电路流向铜棒
C.通过构成原电池,能将反应的化学能全部转化为电能
D.银锌纽扣电池的放电反应:Zn+Ag2O+H2O=Zn(OH)2+2Ag,其中Ag2O作正极,发生还原反应
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温下,向20.00mL0.1000molL﹣1(NH4)2SO4溶液中逐滴加入0.2000molL﹣1NaOH时,溶液的pH与所加NaOH溶液体积的关系如图所示(不考虑挥发).下列说法正确的是( ) 
A.点a所示溶液中:c(NH4+)>c(SO42﹣)>c(OH﹣)>c(H+)
B.点b所示溶液中:c(NH4+)=c(Na+)>c(H+)=c(OH﹣)
C.点c所示溶液中:c(SO42﹣)+c(H+)=c(NH3H2O)+c(OH﹣)
D.点d所示溶液中:c(SO42﹣)>c(NH3H2O)>c(NH4+)>c(OH﹣)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列实验操作与安全事故处理错误的是( )
A.使用水银温度计测量烧杯中水浴温度时,不慎打破水银球,用滴管将水银吸出放入水封的小瓶中,残破的温度计插入装有硫粉的广口瓶中
B.用试管夹从试管底由下往上夹住试管口约 ![]() 处,手持试管夹长柄末端,进行加热
处,手持试管夹长柄末端,进行加热
C.制备乙酸乙酯时,将乙醇和乙酸依次加入到浓硫酸中
D.把玻管插入橡胶塞孔时,用厚布护手,紧握用水湿润的玻管插入端,缓慢旋进塞孔中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】氯化亚铜常用作有机合成工业中的催化剂,为白色晶体,不溶于乙醇,微溶于水,易溶于浓盐酸形成络合离子[CuCl2]﹣ . 受潮露置空气中迅速氧化成碱式盐.实验室用下列流程制备: 
注:①实验药品:硫酸铜晶体12.5g、氯化钠晶体6.0g、水200mL、铜粉3.5g、浓盐酸10mL.
②Na[CuCl2](易电离,溶液无色) ![]() NaCl+CuCl↓ (白色沉淀).
NaCl+CuCl↓ (白色沉淀).
请回答:
(1)写出实验室制取Na[CuCl2]的离子方程式 .
(2)判断步骤②反应完全的现象是 .
(3)步骤④有关抽滤操作,下列说法正确的是 .
A.选择抽滤主要是为了加快过滤速度,得到较干燥的沉淀
B.在吸滤瓶和抽气泵之间应连接一个安全瓶,吸滤瓶应与安全瓶的长导管相接
C.抽滤时不宜过滤胶状沉淀,否则易在滤纸上形成一层密实的沉淀
D.洗涤沉淀时,应关小水龙头,使洗涤剂缓缓通过沉淀物
(4)步骤⑤用乙醇的水溶液洗涤的目的是 .
(5)步骤⑥烘干须在真空干燥箱中进行,其原因是 .
(6)氯化亚铜的定量分析:
①取样品0.25g和10mL过量的FeCl3溶液于250mL锥形瓶中,充分溶解.
②用0.10molL﹣1硫酸锶铈标准溶液滴定.
已知:CuCl+FeCl3=CuCl2+FeCl2; Fe2++Ce4+=Fe3++Ce3+三次平行试验结果如下(平行试验结果相差不能超过1%):
平行试验次数 | 1 | 2 | 3 |
0.25g样品消耗硫酸铈标准溶液的体积(mL) | 24.35 | 24.05 | 23.95 |
则样品中CuCl的纯度为 . (结果保留三位有效数字)
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com