
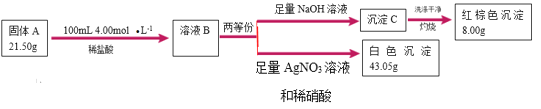
【题目】I.由三种元素组成的难溶化合物![]() 是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究
是一种新型超薄二维纳米材料,可用作锂电池的正极材料。可按如下流程探究![]() 的组成(已知
的组成(已知![]() 与稀盐酸恰好完全反应,且溶液
与稀盐酸恰好完全反应,且溶液![]() 与
与![]() 溶液作用显血红色)。
溶液作用显血红色)。
(1)![]() 中非金属元素是________,
中非金属元素是________,![]() 的化学式是________。
的化学式是________。
(2)固体![]() 与稀盐酸反应的离子方程式是________。
与稀盐酸反应的离子方程式是________。
(3)![]() 、化合物
、化合物![]() 、有机溶剂(可传导
、有机溶剂(可传导![]() )组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为________。
)组成电池,放电时正极生成金属单质和两种含锂的化合物。放电时正极的电极反应式为________。
Ⅱ.草酸亚铁![]() 是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性
是一种难溶于水的淡黄色结晶性粉末,可用于照相显影剂和制药工业。某小组为了检测草酸亚铁中铁元素价态,进行如下实验:取适量样品于试管中,加稀硫酸溶解,滴加适量酸性![]() 溶液,发现
溶液,发现![]() 溶液褪色,说明样品中有二价铁。
溶液褪色,说明样品中有二价铁。
(1)上述实验方案是否科学?说明理由________。
(2)请提出改进的实验方案________。
【答案】![]() 、
、![]()
![]()
![]()
![]() 不科学,因为溶解于硫酸生成的
不科学,因为溶解于硫酸生成的![]() 也具有强的还原性,能使酸性
也具有强的还原性,能使酸性![]() 溶液褪色 取适量样品溶解于稀硫酸中,再加入几滴
溶液褪色 取适量样品溶解于稀硫酸中,再加入几滴![]() 溶液,若溶液不显红色,再滴加适量氯水,溶液显红色,则样品中存在二价铁
溶液,若溶液不显红色,再滴加适量氯水,溶液显红色,则样品中存在二价铁
【解析】
溶液B与氢氧化钠反应得到氢氧化铁,氢氧化铁灼烧生成8gFe2O3,Fe2O3的物质的量是![]() ,则21.5g A中含有铁元素0.2mol;溶液B与硝酸酸化的硝酸银反应43.05g氯化银沉淀,氯化银物质的量是
,则21.5g A中含有铁元素0.2mol;溶液B与硝酸酸化的硝酸银反应43.05g氯化银沉淀,氯化银物质的量是![]() ,则21.5g A中含有氯元素的物质的量是0.3×2-0.1L×4mol/L=0.2mol,根据质量守恒,A中氧元素的物质的量是
,则21.5g A中含有氯元素的物质的量是0.3×2-0.1L×4mol/L=0.2mol,根据质量守恒,A中氧元素的物质的量是![]() ,氧元素的物质的量是
,氧元素的物质的量是![]() ;
;
I.根据以上分析,(1)![]() 中含有Fe、O、Cl元素,非金属元素是
中含有Fe、O、Cl元素,非金属元素是![]() 、
、![]() ,
,![]() 中Fe、O、Cl元素的物质的量分别是0.2mol、0.2mol、0.2mol,A的化学式是
中Fe、O、Cl元素的物质的量分别是0.2mol、0.2mol、0.2mol,A的化学式是![]() ;
;
(2) ![]() 与稀盐酸反应生成氯化铁、水,反应的离子方程式是
与稀盐酸反应生成氯化铁、水,反应的离子方程式是![]() ;
;
(3)![]() 、
、![]() 、有机溶剂(可传导
、有机溶剂(可传导![]() )组成电池,放电时正极
)组成电池,放电时正极![]() 得电子生成铁单质和氧化锂、氯化锂,放电时正极的电极反应式为
得电子生成铁单质和氧化锂、氯化锂,放电时正极的电极反应式为![]() ;
;
Ⅱ. (1)醋酸根离子、亚铁离子都能被高锰酸钾氧化,![]() 溶液褪色,不能说明样品中有二价铁,所以实验方案不科学;
溶液褪色,不能说明样品中有二价铁,所以实验方案不科学;
(2) 取适量样品溶解于稀硫酸中,再加入几滴![]() 溶液,若溶液不显红色,再滴加适量氯水,溶液显红色,则样品中存在二价铁。
溶液,若溶液不显红色,再滴加适量氯水,溶液显红色,则样品中存在二价铁。


科目:高中化学 来源: 题型:
【题目】用下列实验装置进行相应实验,设计正确且能达到实验目的的是

A. 甲用于实验室制取少量CO2 B. 乙用于配制一定物质的量浓度的硫酸
C. 丙用于模拟生铁的电化学腐蚀 D. 丁用于蒸干A1Cl3溶液制备无水AlC13
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】接触法制硫酸工艺中,其主反应如下:
2SO2(g) + O2(g) ![]() 2SO3(g)
2SO3(g) ![]() H=-197 kJ/mol
H=-197 kJ/mol
下列说法正确的是
A. 因为反应放热,所以该反应不需要加热即能快速反应
B. 增大O2的浓度可以提高反应速率和SO2的转化率
C. 反应450℃时的平衡常数小于500℃时的平衡常数
D. 恒温下缩小容器容积,使Q > K
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】电解质的水溶液中存在电离平衡。
(1)醋酸是常见的弱酸。
①醋酸在水溶液中的电离方程式为____________。
②下列方法中,可以使醋酸溶液中CH3COOH电离程度增大的是_______(填字母序号)。
a 滴加少量浓盐酸 b 微热溶液 c 加水稀释 d 加入少量醋酸钠晶体
(2)下表为某同学所测25℃时,甲、乙两种溶液的pH。
甲 | 乙 | |
pH | 11 | 11 |
溶液 | 氨水 | 氢氧化钠溶液 |
①甲溶液中的c(OH-) =___________mol/L。
②25℃时,等体积的甲、乙两溶液与等浓度的盐酸反应,消耗的盐酸体积:甲_____乙。
③甲、乙溶液均加水稀释10倍后,所得溶液的pH:甲_____乙。
(3)已知多元弱酸在水溶液中的电离是分步进行的,且第一步的电离程度大于第二步的电离程度,第二步的电离程度远大于第三步的电离程度……今有HA、H2B、H3C三种弱酸,根据“较强酸 + 较弱酸盐 = 较强酸盐 + 较弱酸”的反应规律,它们之间能发生下列反应:
a.HA + HC2-(少量) = A-+ H2C-
b.H2B(少量) + 2A- = B2- + 2HA
c.H2B(少量) + H2C- = HB-+ H3C
回答下列问题:
①相同条件下,HA、H2B、H3C三种酸中,酸性最强的是_____________。
②下列反应的离子方程式正确的是____________。
A.H3C +3A- = 3HA + C3- B.HB- +A- = HA + B2-
③完成下列反应的离子方程式:
a.H3C + OH-(过量)——__________________;b.HA(过量) + C3- ——_____________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】海水的综合利用可以制备金属镁,其流程如下图所示:
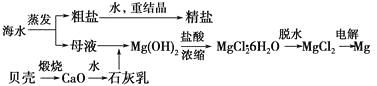
(1)Mg(OH)2沉淀中混有的Ca(OH)2应怎样除去?写出实验步骤。__________________________
(2)实验室将粗盐制成精盐的过程中,溶解、过滤、蒸发三个步骤的操作都要用到玻璃棒,分别说明在这三种情况下使用玻璃棒的目的:
①溶解:________________。
②过滤:__________________________。
③蒸发:________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】![]() 和
和![]() 催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图(图中球棍模型中的“棍”可表示单键、双键或叁键),已知:
催化重整可制备合成气,对减缓燃料危机具有重要的意义,其反应历程示意图如图(图中球棍模型中的“棍”可表示单键、双键或叁键),已知:![]() ,下列说法不正确的是( )
,下列说法不正确的是( )
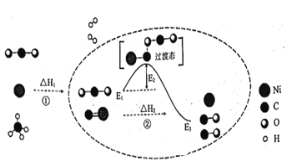
A.反应①为吸热反应,且![]()
B.催化剂![]() 对反应①和反应②都有催化作用
对反应①和反应②都有催化作用
C.反应②过程中既有碳氧键的断裂,也有碳氧键的形成
D.反应②的活化能为![]() ,反应焓变
,反应焓变![]()
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】已知煤的近代结构模型如图所示。
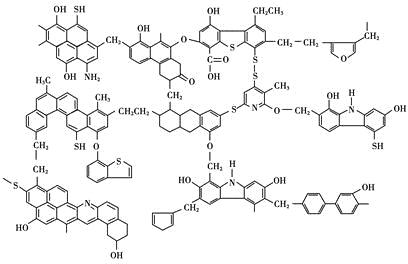
回答下列问题:
(1)从煤的结构模型来看,煤是工业上获得____________的重要来源。
(2)我国大约70%的煤是直接用于燃烧的。从煤的结构模型来看,在提供热量的同时产生大量的____________、____________等气体物质,造成严重的大气污染。
(3)“型煤”技术不仅可以减少87%的废气排放量,烟尘排放量也可减少80%,致癌物苯并[α]芘的排放量也减少,同时节煤20%~30%。“型煤”技术的原理是利用固硫剂在燃烧过程中生成稳定的硫酸盐。某“型煤”生产厂利用石灰石作固硫剂,试用化学方程式表示其固硫过程________________、________________。
(4)为了解决煤燃烧所造成的污染问题和提高煤的利用价值,煤资源的综合利用方法还有____________、____________、____________等。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列叙述中正确的是
A. 稀醋酸与稀氢氧化钠溶液发生中和反应的热化学方程式为CH3COOH (aq) + NaOH (aq) = CH3COONa(aq) + H2O(l) ΔH=![]() 57.3kJ/mol
57.3kJ/mol
B. 在101kPa时1mol物质燃烧时的反应热叫做该物质的燃烧热
C. 未来氢气作为新能源的其中一个优点是充分燃烧的产物不污染环境
D. 升高温度或加入催化剂,可以改变化学反应的反应热
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】Ⅰ.在![]() 密闭容器中放入
密闭容器中放入![]() ,在一定温度进行如下反应:
,在一定温度进行如下反应:![]()
容器内气体总压强(P)与起始压强![]() 的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
的比值随反应时间(t)数据见下表:(提示,密闭容器中的压强比等于气体物质的量之比)
时间 | 0 | 1 | 2 | 4 | 8 | 16 | 20 | 25 | |
| 1.00 | 1.50 | 1.80 | 2.20 | 2.30 | 2.38 | 2.40 | 2.40 |
回答下列问题
(1)下列能提高A的转化率的是_______
A.升高温度 B.体系中通入A气体
C.将D的浓度减小 D.通入稀有气体![]() ,使体系压强增大到原的5倍
,使体系压强增大到原的5倍
(2)该反应的平衡常数的表达式K_______,前2小时C的反应速率是_________![]() ;
;
(3)平衡时A的转化率___________,C的体积分数__________(均保留两位有效数字)
(4)相同条件下,若该反应从逆向开始,建立与上述相同的化学平衡,则D的物质的量取值范围![]() ______
______![]()
Ⅱ.已知乙酸是一种重要的化工原料,该反应所用的原理与工业合成乙酸的原理类似;常温下,将![]() 溶于水配成
溶于水配成![]() 溶液,向其中滴加等体积的
溶液,向其中滴加等体积的![]() 的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数
的盐酸使溶液呈中性(不考虑醋酸和盐酸的挥发),用含a和b的代数式表示醋酸的电离常数![]() ___________
___________
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com