
【题目】如图所示三套实验装置,分别回答下列问题.
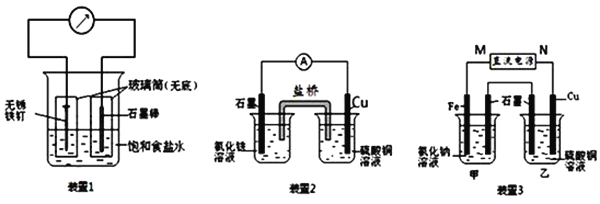
(1)装置1为铁的吸氧腐蚀实验.向插入碳棒的玻璃筒内滴入酚酞溶液,可观察到碳棒附近的溶液变红,该电极反应为______.
(2)装置2中的石墨是______极(填“正”或“负”),该装置发生的总反应的离子方程式为______.
(3)装置3中甲烧杯盛放100mL 0.2mol/L的NaCl溶液,乙烧杯盛放100mL 0.5mol/L的CuSO4溶液.反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红.
①电源的M端为______极;甲烧杯中铁电极的电极反应为______.
②乙烧杯中电解反应的离子方程式为______.
③停止电解,取出Cu电极,洗涤、干燥、称量、电极增重0.64g,甲烧杯中产生的气体标准状况下体积为______mL.
【答案】O2+4e﹣+2H2O═4OH﹣ 正 2Fe3++Cu═2Fe2++Cu2+ 正 Fe﹣2e﹣═Fe2+ 2Cu2++2H2O![]() 2Cu+O2↑+4H+ 224
2Cu+O2↑+4H+ 224
【解析】
(1)装置1为铁的吸氧腐蚀实验,发生电化学腐蚀,铁为负极,碳为正极,观察到碳棒附近的溶液变红,说明在碳极上氧气得电子生成OH-离子,反应的电极反应式为O2+4e-+2H2O═4OH-,
故答案为:O2+4e-+2H2O═4OH-;
(2)装置2为原电池,负极为Cu,电极反应为:Cu-2e-═Cu2+,正极为石墨,电极反应为2 Fe3++2e-═2Fe2+,反应的总方程式为2Fe3++Cu═2Fe2++Cu2+,
故答案为:正;2Fe3++Cu═2Fe2++Cu2+;
(3)①反应一段时间后,停止通电.向甲烧杯中滴入几滴酚酞,观察到石墨电极附近首先变红,说明在石墨电极上生成OH-离子,电极反应为:2H2O+2e-═2OH-+H2↑,发生还原反应,为电解池的阴极,连接电源的负极,即M端为正极,N端为负极,阳极反应为Fe-2e-═Fe2+,故答案为:正;Fe-2e-═Fe2+;
②乙烧杯电解硫酸铜溶液,石墨为阳极,电极反应为4OH--4e-═O2↑+H2O,Cu为阴极,电极反应为Cu2++2e-═Cu,电解的总反应为2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
故答案为:2Cu2++2H2O![]() 2Cu+O2↑+4H+
2Cu+O2↑+4H+
③取出Cu电极,洗涤、干燥、称量、电极增重0.64g,则生成Cu的物质的量为![]() =0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,根据甲烧杯产生气体的电极反应计算生成气体的体积,
=0.01mol,转移的电子的物质的量为0.01mol×2=0.02mol,根据甲烧杯产生气体的电极反应计算生成气体的体积,
2H2O+2e-═2OH-+H2↑,
2mol 22.4L
0.02mol V1
V1=![]() =0.224L,即224ml,
=0.224L,即224ml,
故答案为:224;


科目:高中化学 来源: 题型:
【题目】某同学在实验室中进行如下实验:
编号 | Ⅰ | Ⅱ | Ⅲ |
实验 |
|
|
|
现象 | 没有明显变化,溶液仍为无色 | 有沉淀生成,溶液为蓝绿色 | 有无色气泡产生 |
以下结论不正确的是( )
A.Ⅰ中无明显变化,说明两溶液不反应
B.Ⅱ中的白色沉淀为BaSO4
C.Ⅲ中发生的反应是离子反应
D.Ⅲ中发生反应的离子方程式为2H++Zn=Zn2++H2↑
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如图所示(反应条件已略去)。下列说法错误的是( )
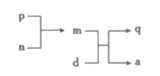
A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点B<C
C.d与m反应的现象为d浮在m液面上四处游动
D.C与D形成的化合物中一定含有离子键
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】宝鸡被誉为“青铜器之乡”,出土了大盂鼎、毛公鼎、散氏盘等五万余件青铜器。研究青铜器(含Cu、Sn等)在潮湿环境中发生的腐蚀对于文物保护和修复有重要意义。下图为青铜器在潮湿环境中发生电化学腐蚀的原理示意图,下列说法不正确的是
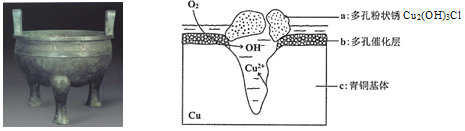
A. 青铜器发生电化学腐蚀,图中c作负极,被氧化
B. 正极发生的电极反应为O2+ 4e-+2H2O=4OH-
C. 环境中的Cl- 与正、负两极反应的产物作用生成a的离子方程式为2Cu2++3OH-+Cl-=Cu2 (OH)3Cl↓
D. 若生成0.2 mol Cu2(OH)3Cl,则理论上消耗的O2体积为4.48L
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】研究SO2、NOx等大气污染物的要善处理具有重要意义。
(1)燃煤发电厂常利用反应2CaCO3(s)+2SO2(g)+O2(g)![]() 2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
2CaSO4(s)+2CO2(g)对煤进行脱硫处理。某温度下,测得反应在不同时间点各物质的浓度如下:
时间/min 浓度/mol·L-1 | 0 | 10 | 20 | 30 | 40 | 50 |
O2 | 1.00 | 0.78 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.44 | 0.80 | 0.80 | 0.88 | 0.88 |
①0~10min内,平均反应速率v(SO2)=___mol/(L·min)。
②30min后,只改变某—条件,反应重新达到平衡。根据上表中的数据判断,改变的条件可能是___(填字母)。
A.移除部分CaSO4(s) B.通入一定量的O2
C.加入合适的催化剂 D.适当缩小容器的体积
(2)利用活性炭吸附汽车尾气中的NO:C(s)+2NO(g)![]() N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
N2(g)+CO2(g),实验测得,v正=k正c2(NO),v逆=k逆c(N2) c(CO2)(k正、k逆为速率常数,只与温度有关)。在密闭容器中加入足量C(s)和一定量的NO气体,保持恒压测得NO的转化率随温度的变化如图所示:
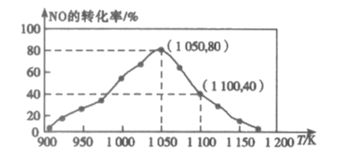
①由图可知:该反应的ΔH___0(填“>”或“<”);在1050K前反应中NO的转化率随温度升高而增大,其原因为___。
②用某物质的平街分压代替其物质的量浓度也可以表示化学平衡常数(记作Kp)。在1050K、1.1×106Pa时,计算该反应的化学平衡常数Kp=___[已知:气体分压(P分)=气体总压(P×体积分数]。
③达到平衡后,仅升高温度,k正增大的倍数___(填“>”、“<”或“=”)k逆增大的倍数,1100K时,计算k正:k逆=___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】金属钠是实验室里常用的一种化学试剂,请回答下列问题:
(1)在实验室里,取用沉浸在煤油中的金属钠的操作方法是__________________。
(2)在空气中切开一块金属钠,可看到断面呈________色,具有金属光泽,但断面很快变____________,主要是由于生成一薄层____________。
(3)若把钠放在石棉网上加热可观察到____________________________________,反应的化学方程式是______________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】现有C2H4(乙烯)和O2两种气体。
(1)两者的质量相等时,在标准状况下,①体积比为________;②密度比为________;③分子数比为________。
(2)在相同状况下,当两者体积相同时,①质量比为________;②密度比为________;③分子数比为__________。
(3)两者的物质的量相同时,①体积比为________;②密度比为________;③质量比为________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】有关新型冠状病毒肺炎的预防,下列说法正确的是( )
A.“84”消毒液和酒精均可用于消毒,混合使用效果更好
B.过氧乙酸![]() 和环氧乙烷
和环氧乙烷![]() 都是高效消毒剂,其杀菌原理相同
都是高效消毒剂,其杀菌原理相同
C.外科口罩对直径![]() 葡萄球菌气溶胶过滤效率不低于
葡萄球菌气溶胶过滤效率不低于![]() ,可用于分离溶液和胶体
,可用于分离溶液和胶体
D.某医用免洗消毒洗手液含有一定浓度的过氧化氢和乙醇,可有效消毒灭菌
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com