
下列实验过程中,始终无明显现象的是
A.NO2通入FeSO4溶液中 B.CO2通入CaCl2溶液中
C.NH3通入AlCl3溶液中 D.SO2通入已酸化的Ba(NO3)2溶液中
科目:高中化学 来源:2015届河南长葛第三实验高中高二下学期第一次考试化学试卷(解析版) 题型:选择题
现有三组混合液:①乙酸乙酯和乙酸钠溶液 ②乙醇和丁醇 ⑧溴化钠和单质溴的水溶液,分离以上各混合液的正确方法依次是( )
A.分液、萃取、蒸馏 B.萃取、蒸馏、分液
C.分液、蒸馏、萃取 D.蒸馏、萃取、分液
查看答案和解析>>
科目:高中化学 来源:2015届河南省高三上学期第一次测试化学试卷(解析版) 题型:选择题
下图是某学校实验室从化学试剂商店买回的硫酸试剂标签上的部分内容。据此下列说法正确的是
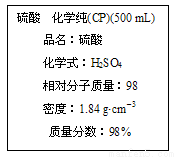
A.该硫酸的物质的量浓度为9.2 mol·L-1
B.1 mol Zn与足量的该硫酸反应产生2 g氢气
C.配制200 mL 4.6 mol·L-1的稀硫酸需取该硫酸50 mL
D.等质量的水与该硫酸混合所得溶液的物质的量浓度大于9.2 mol/L.
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:推断题
(11分)A是自然界存在最广泛的ⅡA族元素,常以化合物F存在。从单质A起始发生的一系列化学反应可由下图表示:
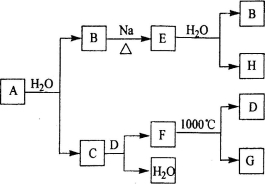
请回答下列问题:
(1)A与水反应的化学方程式为____________,E与水反应的化学方程式为______ _ ______;
(2)F的化学式为_____________,G和D的电子式分别为____________和______________;
(3)D与H反应可能生成的盐有_______ ______ (填化学式);
(4)如何由F制备A : 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省顶级名校高三入学定位考试化学试卷(解析版) 题型:选择题
在一定的温度、压强下,向100mLCH4和Ar的混合气体中通入400mLO2,点燃使其完全反应,最后在相同条件下得到干燥气体460mL,则反应前混合气体中CH4和Ar的物质的量之比为 ( )
A.1:4 B. 1:3 C. 1:2 D. 1:1
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:填空题
(13分)以硫铁矿(主要成分为FeS2)为原料制备氯化铁晶体(FeCl3·6H2O)的工艺流程如下:
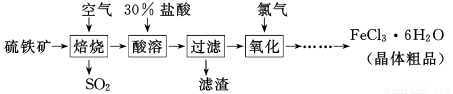
回答下列问题:
Ⅰ、(1)在一定条件下,SO2转化为SO3的化学反应为2SO2(g)+O2(g)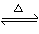 2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
2SO3(g),该反应的平衡常数表达式为K= ;过量的SO2与NaOH溶液反应的化学方程式为 。
(2)酸溶及后续过程中均需保持盐酸过量,其目的是 、 。
(3)通氯气氧化时,发生的主要反应的离子方程式为 ;该过程产生的尾气可用碱溶液吸收,尾气中污染空气的气体为 (写化学式)。
Ⅱ、 已知: CuCl2溶液中含有少量杂质FeCl2,为制备纯净的CuCl2·2H2O晶体,拟定实验步骤如图所示:
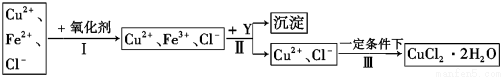
请回答下列问题:
(4)步骤Ⅰ中,将Fe2+转化为Fe3+最好选用下列氧化剂中的 (填字母)。
A.K2Cr2O7 B.NaClO C.H2O2
该反应的离子方程式为 。
(5)在步骤Ⅱ中,加入Y的目的是为了调节溶液的酸度以促使Fe3+沉淀完全,Y可以是下列物质中的 (填字母)。
A.NaOH B.Cu C.Cu2(OH)2CO3
(6)步骤Ⅲ应控制的实验条件是 。
查看答案和解析>>
科目:高中化学 来源:2015届河南省偃师市高三上学期第一次月考化学试卷(解析版) 题型:选择题
下列各组中的两种物质作用,反应条件(温度或反应物用量)改变,不会引起产物种类改变的是
A.Na和O2 B.NaOH和CO2C.Na2O2和CO2 D.AlCl3和NaOH
查看答案和解析>>
科目:高中化学 来源:2015届河北省唐山市高三年级摸底考试理综化学试卷(解析版) 题型:填空题
(13分)实验室用乙酸和正丁醇制备乙酸正丁酯。有关物质的相关数据如下表:
化合物 | 相对分子质量 | 密度/g·cm-3 | 沸点,/℃ | 溶解度/l00g水 |
正丁醇 | 74 | 0.80 | 118.0 | 9 |
冰醋酸 | 60 | 1.045 | 118.1 | 互溶 |
乙酸正丁酯 | 116 | 0.882 | 126.1 | 0.7 |
操作如下:
①在50mL三颈烧瓶中,加入18.5 mL正丁醇和13.4 mL冰醋酸, 3~4滴浓硫酸,投入沸石。安装分水器(作用:实验过程中不断分离除去反应生成的水)、温度计及回流冷凝管。
②将分水器分出的酯层和反应液一起倒入分液漏斗中,水洗, 10% Na2CO3洗涤,再水洗,最后转移至锥形瓶,干燥。
③将干燥后的乙酸正丁酯滤入烧瓶中,常压蒸馏,收集馏分,得15.1 g乙酸正丁酯。

请回答有关问题:
(1)冷水应该从冷凝管 (填a或b)端管口通入。
(2)仪器A中发生反应的化学方程式为____ 。
(3)步骤①“不断分离除去反应生成的水”该操作的目的是: 。
(4)步骤②中用10%Na2CO3溶液洗涤有机层,该步操作的目的是 。
(5)进行分液操作时,使用的漏斗是____ (填选项)。
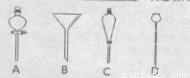
(6)步骤③在进行蒸馏操作时,若从118℃开始收集馏分,产率偏___ (填“高”或者“低”)原因是____
(7)该实验过程中,生成乙酸正丁酯的产率是 。
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com