
【题目】一定温度下,在恒容的密闭容器中加入1 mol N2和3 mol H2发生反应:N2+3H2![]() 2NH3。下列有关说法正确的是
2NH3。下列有关说法正确的是
A.充分反应后,可得到2 mol NH3
B.压强不变时,达到该反应的最大限度
C.达到平衡状态时,v (正)与v (逆)均为零
D.达到平衡状态时,N2、 H2、NH3 物质的量浓度之比一定为1:3:2
【答案】B
【解析】
根据可逆反应和化学平衡状态的特征解答。
A.该反应为可逆反应,1 mol N2和3 mol H2不能完全反应,生成的NH3的物质的量小于2 mol ,A错误;
B.该反应的正反应是一个气体体积减小的反应,在反应过程中压强会不断的减小,当压强不变时,反应达到平衡状态,即达到该反应的最大限度,B正确;
C.化学平衡是动态平衡,当可逆反应达到平衡状态时,反应仍在进行,v (正)与v (逆)相等但不为零,C错误;
D.达到平衡状态时,N2、 H2、NH3 物质的量浓度之比与各物质的初始浓度及反应物的转化率有关,可能等于1:3:2,也可能不等于1:3:2,D错误。
答案选B。


 小学课堂作业系列答案
小学课堂作业系列答案 金博士一点全通系列答案
金博士一点全通系列答案科目:高中化学 来源: 题型:
【题目】铝土矿(主要成分为Al2O3,还含有SiO2、Fe2O3)是工业上制备铝的主要原料。工业上制取铝的工艺流程如下:
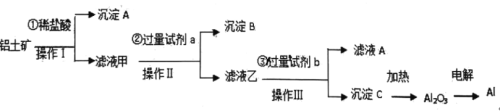
(1)沉淀A____________,沉淀C是___________。
(2)操作Ⅰ、Ⅱ、Ⅲ的名称是___________,所需要的玻璃仪器有___________
(3)滤液甲含有Fe3+,写出硫氰化钾溶液检验Fe3+的离子方程式___________。
(4)生成沉淀C的离子方程式___________
(5)若滤液甲中c(H+)=1.0mol·L-1,c(Al3+)=2.0mol·L-1,c(Fe3+)=2.0mol·L-1,现取100mL滤液,若要把Al3+、Fe3+分开,加入2mol/LNaOH溶液的体积至少为___________mL.
(6)已知铍和铝的性质类似,请写出铍和氢氧化钠溶液反应的离子方程式___________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】常温时,1mol·L-1的CH3NH2和1mol·L-1的NH2OH(NH2OH+H2O![]() NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法不正确的是
NH3OH++OHˉ)两种碱溶液,起始时的体积均为10mL,分别向两溶液中加水进行稀释,所得曲线如图所示(V表示溶液的体积),pOH=-lgc(OH-)。下列说法不正确的是
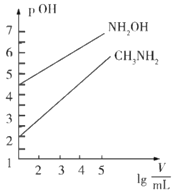
A. NH2OH的电离常数K的数量级为10-9
B. CH3NH3Cl盐溶液中水解离子方程式为:CH3NH2+H2O![]() CH3NH3++OH-
CH3NH3++OH-
C. 当两溶液均稀释至lg![]() =4时,溶液中水的电离程度:NH2OH >CH3NH2
=4时,溶液中水的电离程度:NH2OH >CH3NH2
D. 浓度相同的CH3NH3Cl和NH3OHCl的混合溶液中离子浓度大小关系:(NH3OH+)<c(CH3NH3+)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下表是元素周期表的一部分,回答有关问题。
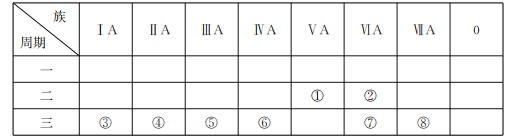
(1)写出元素符号:①___,⑥___。
(2)在这些元素中,最活泼的金属元素的原子结构示意图为___。
(3)在这些元素的最高价氧化物对应的水化物中,酸性最强的物质与碱性最强的物质在水溶液中发生反应的离子方程式为___。
(4)在②、③、④、⑤这些元素形成的最简单离子中,离子半径由大到小的顺序为___(填离子符号)。
(5)由元素②、③、⑧形成的一种常见的杀菌消毒剂中存在的化学键有___。
(6)由元素⑦和⑧形成的某种化合物可表示为X2Y2(其中各原子均满足8电子稳定结构),写出X2Y2的电子式:___。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列推理正确的是
A. 铝粉在氧气中燃烧生成Al2O3,铁丝在氧气中燃烧也生成Fe2O3
B. 铁能从硫酸铜溶液中置换出铜,钠也能从硫酸铜溶液中快速置换出铜
C. 铝片表面易形成致密的氧化膜,钠块表面也易形成致密的氧化膜
D. 钠与氧气、水等反应时钠均作还原剂,金属单质参与氧化还原反应时金属均作还原剂
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】半水煤气是工业合成氨的原料气,其主要成分是H2、CO、CO2、N2和H2O(g)。半水煤气经过下列步骤转化为合成氨的原料。
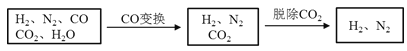
完成下列填空:
(1)半水煤气含有少量硫化氢。将半水煤气样品通入____溶液中(填写试剂名称),出现_______,可以证明有硫化氢存在。
(2)半水煤气在铜催化下实现CO变换:CO+H2O![]() CO2+H2
CO2+H2
若半水煤气中V(H2):V(CO):V(N2)=38:28:22,经CO变换后的气体中:V(H2):V(N2)=____________。
(3)碱液吸收法是脱除二氧化碳的方法之一。已知:
Na2CO3 | K2CO3 | |
20℃碱液最高浓度(mol/L) | 2.0 | 8.0 |
碱的价格(元/kg) | 1.25 | 9.80 |
若选择Na2CO3碱液作吸收液,其优点是__________;缺点是____________。如果选择K2CO3碱液作吸收液,用什么方法可以降低成本?
___________________________________________
写出这种方法涉及的化学反应方程式。_______________________
(4)以下是测定半水煤气中H2以及CO的体积分数的实验方案。
取一定体积(标准状况)的半水煤气,经过下列实验步骤测定其中H2以及CO的体积分数。
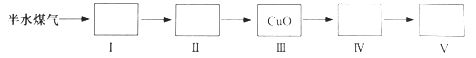
①选用合适的无机试剂分别填入Ⅰ、Ⅰ、Ⅳ、Ⅴ方框中。
②该实验方案中,步骤Ⅰ、Ⅱ的目的是:_________________。
③该实验方案中,步骤________(选填“Ⅳ”或“Ⅴ”)可以确定半水煤气中H2的体积分数。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】催化还原CO2是解决温室效应及能源问题的重要手段之一。研究表明,在Cu/ZnO催化剂存在下,CO2和H2可发生两个平行反应,分别生成CH3OH和CO。反应的热化学方程式如下:
CO2(g)+3H2(g)![]() CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CH3OH(g)+H2O(g) ΔH1=-53.7kJ·mol-1 I
CO2(g)+H2(g)![]() CO(g)+H2O(g) ΔH2 II
CO(g)+H2O(g) ΔH2 II
某实验室控制CO2和H2初始投料比为1:2.2,在相同压强下,经过相同反应时间测得如下实验数据:
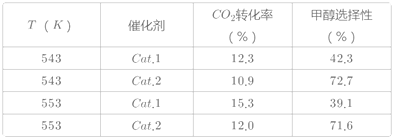
(备注)Cat.1:Cu/ZnO纳米棒;Cat.2:Cu/ZnO纳米片;甲醇选择性:转化的CO2中生成甲醇的百分比
已知:①CO和H2的标准燃烧热分别为-283.0kJ·mol-1和-285.8kJ·mol-1
②H2O(l)=H2O(g)ΔH3=44.0kJ·mol-1
请回答(不考虑温度对ΔH的影响):
(1)反应I的平衡常数表达式K=___;
(2)有利于提高CO2转化为CH3OH平衡转化率的措施有___。
A.使用催化剂Cat.1
B.使用催化剂Cat.2
C.降低反应温度
D.投料比不变,增加反应物的浓度
E.增大CO2和H2的初始投料比
(3)表中实验数据表明,在相同温度下不同的催化剂对CO2转化成CH3OH的选择性有显著的影响,其原因是___。
(4)在图中分别画出反应I在无催化剂、有Cat.1和有Cat.2三种情况下“反应过程~能量”示意图___。

查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某化学小组为了证明SO2和Cl2的漂白性,设计了如图所示的实验装置:
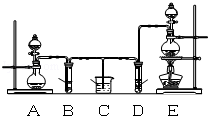
(1)他们制备Cl2依据的原理是:MnO2+4HCl(浓)△MnCl2+2H2O+Cl2↑,应选用图A、E装置中的 (填序号)制Cl2,反应中浓盐酸所表现出的性质是 、 .
(2)反应开始后,发现B、D两个试管中的品红溶液都褪色,停止通气后,给B、D两个试管中的液体加热,B试管中的现象是 .
(3)写出过量NaOH溶液与SO2气体反应的离子方程式是 .
(4)该小组同学将两种气体混合后通入品红溶液,一段时间后,品红溶液几乎不褪色.查阅资料得知:两种气体按体积比1:1混合,再与水反应可生成两种常见的酸,因而失去漂白作用,该反应的化学方程式是 .
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】配制一定物质的量浓度的NaCl溶液时,下列操作不正确的是( )
A. 接近称量质量时,轻振手腕,加够药品
B. 溶解时,用量筒控制所加蒸馏水的量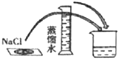
C. 移液时,玻璃棒插在刻度线上,防止液体洒出![]()
D. 接近刻度线1~2cm时,用胶头滴管滴加蒸馏水至刻度线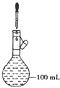
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com