
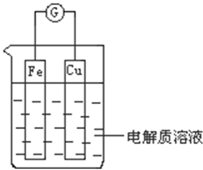
 能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
能量是一个世界性的话题,如何充分利用能量、开发新能源,为人类服务是广大科技工作者不懈努力的目标.
| ||
| ||
| 1 |
| 2 |
| 1 |
| 2 |


 小题狂做系列答案
小题狂做系列答案科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、少量金属钠加到冷水中:Na+H2O=Na++OH-+H2↑ |
| B、铁与稀盐酸反应:2Fe+6H+=2 Fe3++3H2↑ |
| C、氯气通入冷的氢氧化钠溶液中:Cl2+2OH-=Cl-+ClO-+H2O |
| D、过量的二氧化碳通入氢氧化钠溶液:CO2+2OH-=CO32-+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、太阳能电池的主要材料为二氧化硅 |
| B、锌锰干电池工作原理与太阳能电池工作原理相同 |
| C、氢氧燃料电池工作时氢气在负极被还原 |
| D、锂离子电池优点是提供相同的电量所需的金属质量小 |
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、反应①为放热反应 |
| B、碳的燃烧热大于110.5 kJ?mol-1 |
| C、浓硫酸和NaOH反应的中和热为-57.3 kJ?mol-1 |
| D、稀醋酸与稀NaOH反应生成1mol水,放出57.3 kJ的热量 |
查看答案和解析>>
科目:高中化学 来源: 题型:
A、甘氨酸(α-氨基乙酸)与氢氧化钠溶液反应: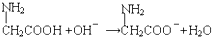 | ||
| B、高级脂肪酸与氢氧化钠溶液反应:H++OH-=H2O | ||
| C、苯酚钠溶液中通入少量CO2:2C6H5O-+H2O+CO2→2C6H5OH+CO32- | ||
D、乙醛与银氨溶液的反应:CH3CHO+2[Ag(NH3)2]++2OH-
|
查看答案和解析>>
科目:高中化学 来源: 题型:
| A、①③ | B、②⑤ | C、③④ | D、③⑤ |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com