
����Ŀ�����ڰ��ĺϳɹ�ҵ������˵����ȷ����(����)
A.�Ӻϳ������������壬���а���һ��ռ15%�������������Ĺ�ҵ��Ч�ʶ��ܵ�
B.����NH3��Һ����N2��H2��ѭ��ʹ�ã����ܵ�˵�����IJ��ʺܸ�
C.�ϳɰ���ҵ�ķ�Ӧ�¶ȿ�����400��500 �����ң�Ŀ����ʹƽ��������Ӧ�������
D.�ϳɰ���ҵ����10 MPa��30 MPa������������´����Ļ������

| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����ĸ������ܱ������а����±���Ӧ���������壬����2N2O(g) ![]() 2N2(g)+O2(g)������I��II��III��N2Oƽ��ת����������ͼ��ʾ������˵����ȷ����( )
2N2(g)+O2(g)������I��II��III��N2Oƽ��ת����������ͼ��ʾ������˵����ȷ����( )
���� | �ݻ�/L | ��ʼ���ʵ���/L |
| ||
N2O | N2 | O2 | |||
I | V1 | 0.1 | 0 | 0 | |
II | 1.0 | 0.1 | 0 | 0 | |
III | V2 | 0.1 | 0 | 0 | |
IV | 1.0 | 0.06 | 0.06 | 0.04 | |
A. �÷�Ӧ������Ӧ����
B. ��ͬ�¶��·�Ӧʱ��ƽ����Ӧ���ʣ�v(I)>v(��)
C. ͼ��A��B��C���㴦��������ѹǿ��V��III����V��II����V��I��
D. ����IV��470����з�Ӧʱ����ʼ���ʣ�v(N2O)����v(N2O)��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪��A��BΪ���ʣ�CΪ����ɫ���壬A��B��C��D��E��F������ת����ϵ
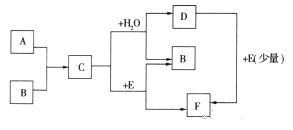
��1��д��A��B��E�Ļ�ѧʽ��
A_________________��B_________________��E___________________��
��2��������л�ѧ��Ӧ����ʽ��
��C+H2O��__________________________________��
��D+E��_____________________________________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������NaHCO3�����ʣ�����˵����ȷ����(˫ѡ)(����)
A.���ᷴӦ�ų�������CO2�����ĵ����Na2CO3��
B.��ͬ�¶����ܽ�ȱ�Na2CO3Ҫ��
C.���ȶ��Ա�Na2CO3��
D.NaHCO3ֻ�ܺ������ò��ܺͼ�����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������϶����ŵij������������ػ�������е�3������е���Դ����ΪҺ̬H2��Һ̬O2�������ķ�ӦΪ2H2(g)��O2(g)===2H2O(g)������˵������ȷ����(����)

A. ���Ϸ�Ӧ���Ƿ��ȷ�Ӧ
B. 2 mol��̬H2��1 mol��̬O2������������2 molˮ������������
C. ����2 mol H��H����1 mol O��O�����յ�������С���γ�4 mol H��O���ͷŵ�������
D. ����ȼ�չ����������仯������ͼ��ʾ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����ͼ��ʾ������I�̶��������������������ƶ���M��N���������о�������Ӧ��A(g)+2B(g)![]() xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )
xC(g)��H=��192kJmol��1����M��N�ж�ͨ��1mol A��2mol B�Ļ�����壬��ʼM��N�ݻ���ͬ�������¶Ȳ��䣮����˵����ȷ����( )

A. ��x=3���ﵽƽ���A�����������ϵΪ����(M)����(N)
B. ��x��3���ﵽƽ���B��ת���ʹ�ϵΪ����(M)����(N)
C. ��x��3��C��ƽ��Ũ�ȹ�ϵΪ��c(M)��c(N)
D. x����Ϊ��ֵ����ʼʱ��N�����г�������ֵ��C��ƽ���N������A��Ũ�Ⱦ����
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������Դ���������й㷺��;������(Ni)�������缫���ŨNaOH�����Ʊ���������Na2FeO4��װ����ͼ��ʾ�������ƶϺ�������

A. �����������缫��ӦΪ4OH--4e-=O2��+2H2O
B. ���ʱ�����ķ���Ϊ:������Ni�缫����Һ��Fe���缫������
C. ����ĤΪ�����ӽ���Ĥ����OH-���������ƶ�
D. ���ʱ������pH���͡�������pH����(������ǰ������仯���Բ���)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������������������ɢϵ�ı���������
A. �������Ӵ���� B. �������ӵ�ֱ����1��100nm֮��
C. ���������ܹ����������˶� D. �������Ӳ��ܴ�����Ĥ
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com