
����Ŀ����ʽ�Ȼ�þ(MgOHCl)�������������Ӽ�����ҵ���Ʊ������϶࣬��������������þ�ȷֽ��Ȼ���ư������õ���ʽ�Ȼ�þ�Ĺ��������ҹ��״���ij��ѧ����С����ݸ�ԭ���������װ��ͼ�������ʵ�飬װ��C��CuO������Ϊ8.0 g��
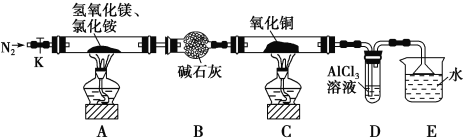
��ش��������⣺
��1��װ��A�з�����Ӧ���ɼ�ʽ�Ȼ�þ�Ļ�ѧ����ʽΪ��_____________________________��
��2��װ��D�����ɳ�����������Ӧ�����ӷ���ʽΪ_________________________________��
��3����Ӧ�����г���ͨ��N2�����������㣺һ��: ��װ��A�в����İ�����ȫ����������:_______________________________��
��4������ü�ʯ�ҵ�����������a g����õ���ʽ�Ȼ�þ������Ϊ_______g��
��5����Ӧ��ϣ�װ��C�е�����ͭȫ���ɺ�ɫ��Ϊ��ɫ����������Ϊ6.8 g�������ɵ������ֱ���ŷŵ������У����ɫ������_______���÷�Ӧ��ת�Ƶ��ӵ����ʵ���Ϊ_______mol��
��6���������һ��ʵ�鷽��֤��װ��C�е�����ͭ��Ӧ��ȫ��õ��ĺ�ɫ�����к���������ͭ����֪����Cu2O��2H��===Cu2����Cu��H2O
����ѡ�Լ���2 mol��L��1H2SO4��Һ��Ũ���ᡢ2 mol��L��1HNO3��Һ��10 mol��L��1 HNO3��Һ
ʵ�鲽�� | Ԥ������ͽ��� |
����1��ȡ��Ӧ��װ��C�е������������Թ��� | |
����2��____________ | ____________ |
���𰸡�Mg(OH)2��NH4Cl![]() MgOHCl��NH3����H2O Al3����3NH3��H2O=Al(OH)3����3NH ϡ�Ͱ�������ֹ���� 4.25a Cu��Cu2O 0.15 ���Թ��м�������2 mol��L��1H2SO4��Һ ��Һ�����ɫ��˵����ɫ�����к���Cu2O
MgOHCl��NH3����H2O Al3����3NH3��H2O=Al(OH)3����3NH ϡ�Ͱ�������ֹ���� 4.25a Cu��Cu2O 0.15 ���Թ��м�������2 mol��L��1H2SO4��Һ ��Һ�����ɫ��˵����ɫ�����к���Cu2O
��������
A�з�Ӧ�õ�MgOHCl��������NH3��H2O����ʯ�Ҹ��ﰱ����C�а���������ͭ��Ӧ��õ�������ˮ��D���������ˮ��Ӧ����������D�а���������������������F��NO��������Ӧ�õ�����������G�ж��������ܽ�õ����ᣬ������Cu��Ӧ���ݴ˷������
(1)A��������þ���Ȼ���ټ��������·�Ӧ����MgOHCl��NH3��H2O����Ӧ����ʽΪ��Mg(OH)2+NH4Cl ![]() MgOHCl+NH3��+H2O���ʴ�Ϊ��Mg(OH)2+NH4Cl
MgOHCl+NH3��+H2O���ʴ�Ϊ��Mg(OH)2+NH4Cl ![]() MgOHCl+NH3��+H2O��
MgOHCl+NH3��+H2O��
(2)��ˮ���Ȼ�����Ӧ�����Ȼ�狀�������������Ӧ�����ӷ���ʽΪAl3++3NH3H2O=Al(OH)3��+3NH4+���ʴ�Ϊ��Al3++3NH3H2O=Al(OH)3��+3NH4+��
(3)G�ж���������������������ˮ���ܽ�ᵼ�µ�����ͨ�뵪������ϡ�Ͱ�������ֹ�������ʴ�Ϊ��ϡ�Ͱ�������ֹ������
(4)����ü�ʯ�ҵ�����������a g�������ɵ�ˮ������Ϊag������Mg(OH)2+NH4Cl ![]() MgOHCl+NH3��+H2O�����ɵļ�ʽ�Ȼ�þ������Ϊ
MgOHCl+NH3��+H2O�����ɵļ�ʽ�Ȼ�þ������Ϊ![]() ��76.5g/mol=4.25a g���ʴ�Ϊ��4.25a��
��76.5g/mol=4.25a g���ʴ�Ϊ��4.25a��
(5)��ɫ����ΪCu��Cu2O�����������������������Ϊ���ٵ���Ԫ������������ٵ���Ԫ������Ϊ8g-6.8g=1.2g����CuO����Ԫ������Ϊ8.0g�� ![]() =1.6g��1.2g���ʺ�ɫ����ΪCu��Cu2O������������ʵ����ֱ�Ϊxmol��ymol����x+2y��
=1.6g��1.2g���ʺ�ɫ����ΪCu��Cu2O������������ʵ����ֱ�Ϊxmol��ymol����x+2y��![]() ��64x+144y�����x=0.05��y=0.025����ת�Ƶ���Ϊ0.05mol��2+0.025mol��2=0.15mol���ʴ�Ϊ��Cu��Cu2O��0.15��
��64x+144y�����x=0.05��y=0.025����ת�Ƶ���Ϊ0.05mol��2+0.025mol��2=0.15mol���ʴ�Ϊ��Cu��Cu2O��0.15��
(6)Cu����Ũ���ᷴӦ��Cu2O����ϡ�ᷴӦ�õ�Cu2+����ϡH2SO4��Һ�ܽ⣬��Һ�г�����ɫ��˵����ɫ�����к���Cu2O���ʴ�Ϊ�����Թ��м�������2 mol��L��1H2SO4��Һ����Һ�����ɫ��˵����ɫ�����к���Cu2O��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������������ȷ����( )
A. ������NaOH��Һ����MgCl2��AlCl3 B. ��������ˮ����������ϩ
C. �����÷�Һ©������������Ҵ� D. ������NaOH��Һ��ȥ����������Br2
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij�л���Ľṹ��ʽΪCH3��CH=CH��Cl�����л����ܷ���(�� ��)
��ȡ����Ӧ���ڼӳɷ�Ӧ������ȥ��Ӧ����ʹ��ˮ��ɫ����ʹ����KMnO4��Һ��ɫ������AgNO3��Һ��Ӧ���ɰ�ɫ�������Ӿ۷�Ӧ
A.���Ϸ�Ӧ���ɷ���B.ֻ�Т߲��ܷ���
C.ֻ�Т��ܷ���D.ֻ�Тڲ��ܷ���
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ڳ��³�ѹ�¶���1 molָ�����ۼ�ʱ���յ��������±���
���ۼ�(1mol) | C��H�� | C��C�� | C��C�� | H��H�� |
���յ�����/kJ | 413.4 | 347.7 | 615 | 436 |
�������й�CH2��CH2��H2����CH3CH3��Ӧ��˵����ȷ����( )
A. ����1mol����ʱ��Ӧ�ų�����123.5kJ
B. �������������Ϊ2828.1kJ
C. �÷�ӦΪ�ӳɷ�Ӧ������ʵ����ȫת��
D. �÷�ӦΪ���ȷ�Ӧ��������ȼ���ʵ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����������ͼʾ���ó��Ľ��۲���ȷ����

A. ͼ����CO(g)+H2O(g)![]() CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ������˵���÷�Ӧ����H<0
CO2(g)+H2(g)��ƽ�ⳣ���뷴Ӧ�¶ȵĹ�ϵ������˵���÷�Ӧ����H<0
B. ͼ����������H2O2���ֽ�ų������ķ�Ӧ��c(H2O2 )�淴Ӧʱ��仯��������˵�����ŷ�Ӧ�Ľ���H2O2�ֽ�������С
C. ͼ������������0.1000 mol��L1NaOH��Һ�ζ�20.00 mL 0.1000 mol��L1ijһԪ��HX�ĵζ�������˵��HX��һԪǿ��
D. ͼ������������Na2SO4��ȥ��Һ��Ba2+�ﵽ�����ܽ�ƽ��ʱ����Һ��c(Ba2+ )��c(SO42)�Ĺ�ϵ������˵����Һ��c(SO42 )Խ��c(Ba2+ )ԽС
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ���ּ��仯��������������������ܣ���������ӡ������ȷ������Ź㷺��Ӧ�á����Ѱ�ҵ���ᣨ���֡��ѡ������̵����ӣ�����ȡ�����֣�Sc2O3����һ���������£�

�ش��������⣺
��l��ϴ�ӡ����ࡱ�ɳ�ȥ�����������ӡ�ϴ��ˮ����93%�����ᡢ27.5%��˫��ˮ��ˮ��һ��������϶��ɡ���ϵ�ʵ�������__________��
��2���ȼ��백ˮ����pH =3�����ˣ�������Ҫ�ɷ���_______��������Һ���백ˮ����pH=6����Һ��Sc3+��Ũ��Ϊ________��[��֪��Ksp[Mn(OH)2]=1.9��10-13��Ksp[Fe(OH)3]=2.6��10-39��Ksp[Sc(OH)3]=9.0��10-31]
��3���ò��ᡰ���֡���25��ʱpH=2�IJ�����Һ��![]() =_______��������λ��Ч���֣���д�������֡��õ������ֵ����ӷ���ʽ_________��
=_______��������λ��Ч���֣���д�������֡��õ������ֵ����ӷ���ʽ_________��
����֪Kal(H2C2O4)=5.9��10-2��Ka2(H2C2O4)=6.4��10-5��
��4�������֡����ա������Ļ�ѧ����ʽΪ_____________��
��5�������к�����Ϊ15mg/L��V L����������ȡSc2O3������Ϊ____________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ������˵����ȷ����
A. ��Ҫ���Ȳ��ܷ����ķ�Ӧ�����ȷ�Ӧ
B. ���ȷ�Ӧһ����Ҫ���Ȳ��ܷ���
C. ���еķֽⷴӦ�������ȷ�Ӧ
D. ��Ҫ�������Ȳ��ܷ����ķ�Ӧ�����ȷ�Ӧ
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����֪CO��H2��һ�������ºϳɼ״��ķ�ӦΪ��CO(g)+2H2(g)![]() CH30H(g)�������ݻ���Ϊl L��a��b��c�����ܱ������зֱ����l molCO��2mol H2�Ļ�����壬�����¶ȣ����з�Ӧ�����������ݵĹ�ϵ��ͼl��ͼ2��ʾ������˵����ȷ���ǣ� ��
CH30H(g)�������ݻ���Ϊl L��a��b��c�����ܱ������зֱ����l molCO��2mol H2�Ļ�����壬�����¶ȣ����з�Ӧ�����������ݵĹ�ϵ��ͼl��ͼ2��ʾ������˵����ȷ���ǣ� ��
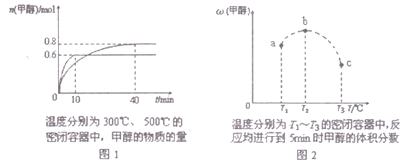
A. �÷�Ӧ������Ӧ�ġ�H>0
B. ���»��ѹ���ɽ�b�е�ƽ��״̬ת��ɴ�c�е�ƽ��״̬
C. ��Ӧ���е�5minʱ��a������v(��)= v(��)
D. �ﵽƽ��ʱ��a��b��c��COת����Ϊb>a>c
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�����и������ʳ��Ӻͷ��뷽����ȷ����( )
���ᴿ���� | �����Լ� | ���뷽�� | |
A | ��(������) | ��ʯ�� | ���� |
B | ��������(����) | ����������Һ | ��Һ |
C | ����(��ϩ) | ���Ը��������Һ | ϴ�� |
D | ��(����) | Ũ��ˮ | ���� |
A.AB.BC.CD.D
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com