
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: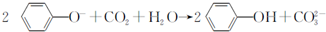 |
分析 A.氯化银为沉淀,应保留化学式;
B.硅酸钠与盐酸反应生成硅酸胶体和氯化钠;
C.漏掉铵根离子与氢氧根离子的反应;
D.不符合反应客观事实.
解答 解:A.向Na2S溶液中加入少量的氯化银,离子方程式:S2-+2AgCl═Ag2S↓+2Cl-,故A错误;
B.向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失,离子方程式:SiO32-+2H+═H2SiO3(胶体),故B正确;
C.碳酸氢铵溶液中加入足量NaOH:NH4++HCO3-+2OH-═CO32-+H2O+NH3•H2O,故C错误;
D.向苯酚钠溶液中通入一定量CO2,离子方程式:C6H5O-+CO2+H2O→C6H6OH+HCO3-,故D错误;
故选:B.
点评 本题考查了离子方程式的书写,明确反应实质及离子方程式书写方法是解题关键,注意化学式拆分、注意离子反应遵循客观事实,注意反应物用量对反应的影响,题目难度不大.


科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
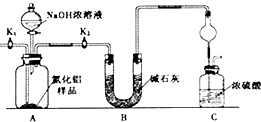
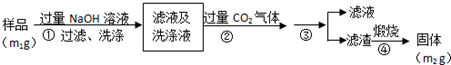
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+Cl2═2HCl | B. | CuO+2H+═Cu2++H2O | ||
| C. | H2O+CaO═Ca(OH)2 | D. | NaOH+HCl═H2O+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,14 g丙烯和丁烯的混合气体含有的原子数为6NA | |
| B. | 25℃,pH=1的1 L H2SO4溶液含有的H+数目为0.2NA | |
| C. | 1 mol Fe与一定量的HNO3反应,转移的电子数目一定为3NA | |
| D. | 标准状况下,22.4 L NO和O2的混合气体中所含原子数为2NA |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 用稀HNO3溶解Fe3O4固体的离子方程式:Fe3O4+8H+═2Fe3++Fe2++4H2O | |
| B. | 将SO2通入H2S溶液中的化学方程式:SO2+2H2S═3S+2H2O | |
| C. | 氢溴酸与氢氧化钠发生中和反应的离子方程式:H++OH-═H2O | |
| D. | 向明矾溶液中加入过量的氨水发生反应的离子方程式:Al3++4OH-═${AlO}_{2}^{-}$+2H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,17 g ND3中所含分子数目NA | |
| B. | 25℃,pH=11的Na2CO3溶液中由水电离出的H+的数目为10-3NA | |
| C. | 用惰性电极电解CuSO4溶液后,如果加入0.1mol Cu(OH)2能使溶液复原,则电路中转移电子的数目为0.4NA | |
| D. | 6g SiO2所含分子数为0.1NA,化学键总数为0.4 NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
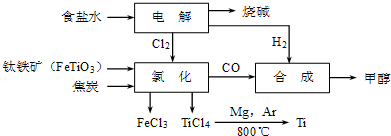
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com