
分析 (1)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大;pH=11的NaOH溶液中c(OH-)=0.01mol/L、pH=1的硫酸中c(H+)=0.1mol/L,二者混合后pH=2,溶液呈酸性,混合溶液中c(H+)=0.01mol/L,则混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$;
(2)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大;
(4)酸、强酸酸式盐或碱抑制水电离,含有弱离子的盐促进水电离.
解答 解:(1)水的电离是吸热反应,升高温度促进水电离,水的离子积常数增大,该温度下离子积常数大于20℃时的离子积常数,所以该温度大于25℃;pH=11的NaOH溶液中c(OH-)=0.01mol/L、pH=1的硫酸中c(H+)=0.1mol/L,二者混合后pH=2,溶液呈酸性,混合溶液中c(H+)=0.01mol/L,则混合溶液中c(H+)=$\frac{0.1mol/L×bL-0.01mol/L×aL}{(a+b)L}$=0.01mol/L,a:b=9:2,故答案为:>;9:2;
(2)化学式中铵根离子个数相等的强电解质中,醋酸根离子促进铵根离子水解,氢离子抑制铵根离子水解,一水合氨是弱电解质,其电离程度较小,所以等浓度的这几种溶液中,铵根离子浓度大小顺序是⑥④⑤⑦,故答案为:⑥④⑤⑦;
(3)酸或碱抑制水电离,含有弱离子的盐促进水电离,酸中氢离子浓度越大或碱中氢氧根离子浓度越大,其抑制水电离程度越大,等浓度的这几种溶液中,NH4Cl促进水电离,H2SO4中氢离子浓度是0.2mol/L、醋酸中氢离子浓度小于0.1mol/L、NaOH中氢氧根离子浓度为0.1mol/L,所以①.②.③.④四种溶液中由水电离出的H+浓度由大到小的顺序是④②③①,故答案为:④②③①;
(4)酸、强酸酸式盐或碱抑制水电离,含有弱离子的盐促进水电离,①②是酸、③是碱,这三种物质都抑制水电离,④⑤是含有弱离子的盐,都促进水电离,
故答案为:④、⑤.
点评 本题考查弱电解质的电离及盐类水解,为高频考点,明确弱电解质电离特点及水电离影响因素是解本题关键,侧重考查学生分析判断及总结归纳能力,知道哪些物质促进水电离、哪些物质抑制水电离,题目难度不大.


科目:高中化学 来源: 题型:解答题

| 物质 | Fe(OH)3 | Cu(OH)2 | Ca(OH)2 | Mn(OH)2 | CuS | CaS | MnS | MnCO3 |
| pKsp | 37.4 | 19.32 | 5.26 | 12.7 | 35.2 | 5.86 | 12.6 | 10.7 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 乙酸具有挥发性 | B. | 乙酸是一元酸 | ||
| C. | 乙酸是有机酸而碳酸是无机酸 | D. | 乙酸能与碳酸氢钠反应放出CO2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
 某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )
某温度下,相同pH值的盐酸和醋酸溶液分别加水稀释,pH值随溶液体积变化的曲线如图所示.据图判断正确的是( )| A. | 水电离程度d<a<b<c | |
| B. | b点溶液的导电性比c点溶液的导电性弱 | |
| C. | a点KW的数值比c点KW的数值大 | |
| D. | b点酸的总浓度大于a点酸的总浓度 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ |
| 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol•L-1的醋酸溶液 | 0.1mol•L-1的NaOH溶液 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 向Na2S溶液中加入少量的氯化银:S2-+2Ag+═Ag2S↓ | |
| B. | 向滴有酚酞的1 mol/L硅酸钠溶液中加入稀盐酸至溶液红色消失:SiO${\;}_{3}^{2-}$+2H+═H2SiO3(胶体) | |
| C. | 碳酸氢铵溶液中加入足量NaOH:HCO${\;}_{3}^{-}$+OH-═CO${\;}_{3}^{2-}$+H2O | |
| D. | 向苯酚钠溶液中通入一定量CO2: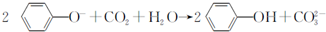 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com