
 常温下有下列四种溶液:
常温下有下列四种溶液:| 序号 | ① | ② | ③ | ④ |
| 溶液 | pH=4的NH4Cl溶液 | pH=4的盐酸 | 0.1mol•L-1的醋酸溶液 | 0.1mol•L-1的NaOH溶液 |
分析 (1)滴定终点时溶液pH在所选取指示剂变色范围内,据此确定指示剂;酸或碱抑制水电离,含有弱离子的盐促进水电离,①②溶液中由水电离出的c(H+)分别为10-4mol/L、10-10mol/L;
(2)氢离子抑制铵根离子水解、醋酸根离子和碳酸氢根离子促进铵根离子水解,醋酸根离子水解程度小于碳酸氢根离子,弱酸根离子水解程度越大,铵根离子水解程度越大;
(3)醋酸体积为10mL时,混合溶液中的溶质为等物质的量浓度的CH3COONa、NaOH,溶液呈碱性,溶液中部分CH3COO-水解,据此判断离子浓度大小;醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量稍微大于NaOH.
解答 解:(1)滴定终点时溶液pH在所选取指示剂变色范围内,醋酸钠溶液呈碱性,其溶液pH>7,酚酞的变色范围为5-8,故选酚酞;酸或碱抑制水电离,含有弱离子的盐促进水电离,①②溶液中由水电离出的c(H+)分别为10-4mol/L、10-10mol/L,所以;①②溶液中由水电离出的c(H+)之比为:10-4mol/L:10-10mol/L=106:1,故答案为:酚酞;106:1;
(2)H+抑制NH4+水解、CH3COO-和HCO3-促进NH4+水解,水解程度:CH3COO-<HCO3-,弱酸根离子水解程度越大,NH4+水解程度越大,所以铵根离子浓度大小顺序是④>①>③>②,
故答案为:④>①>③>②;
(3)醋酸体积为10mL时,混合溶液中的溶质为等物质的量浓度的CH3COONa、NaOH,溶液呈碱性,溶液中部分CH3COO-水解,所以离子浓度大小顺序为c(Na+)>c(OH-)>c(CH3COO-)>c(H+);醋酸钠溶液呈碱性,要使混合溶液呈中性,则醋酸物质的量稍微大于NaOH,所以V>20,
故答案为:c(Na+)>c(OH-)>c(CH3COO-)>c(H+);>.
点评 本题考查弱电解质的电离、离子浓度大小比较等知识点,会根据离子性质确定离子浓度大小,注意(1)中水电离出氢离子浓度的计算方法,为易错点,题目难度中等,侧重于考查学生的分析能力和计算能力.


科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 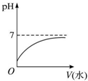 | |
| B. | 溶液中$\frac{c(C{H}_{3}CO{O}^{-})}{c(C{H}_{3}COOH)•c(O{H}^{-})}$不变 | |
| C. | 溶液中导电粒子的数目增加 | |
| D. | 再加入10 mL pH=11的NaOH溶液,恰好完全中和 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
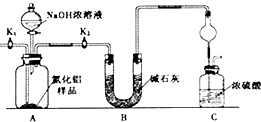
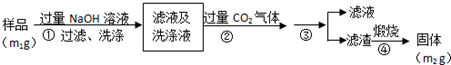
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | H2+Cl2═2HCl | B. | CuO+2H+═Cu2++H2O | ||
| C. | H2O+CaO═Ca(OH)2 | D. | NaOH+HCl═H2O+NaCl |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
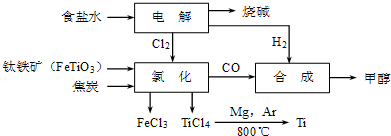
 TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;
TiO2•xH2O↓+4HCl△H>0可知,加入大量水并加热,都能使水解反应向正反应方向进行,促进水解趋于完全;| TiCl4 | Mg | MgCl2 | Ti | |
| 熔点/℃ | -25.0 | 648.8 | 714 | 1667 |
| 沸点/℃ | 136.4 | 1090 | 1412 | 3287 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com