
【题目】在给定条件下,下列选项所示的物质间转化均能实现的是
A.Cu2S(s) ![]() Cu(s)
Cu(s)![]() CuCl2(s)
CuCl2(s)
B.CaCl2(aq) ![]() CaCO3(s)
CaCO3(s)![]() CaO(s)
CaO(s)
C.Fe(s) ![]() Fe2O3(s)
Fe2O3(s) ![]() Fe(s)
Fe(s)
D.NH3 (g)![]() NO (g)
NO (g)![]() HNO3 (aq)
HNO3 (aq)
 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:
【题目】现有168g NaHCO3 固体,加热到质量不再变化为止,试计算:
(1)剩余固体的质量(m);__________
(2) (标准状况下)产生气体的体积v。__________
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】钕铁硼磁铁是目前为止具有最强磁力的永久磁铁。预计在未来20年里,不可能有替代钕铁硼磁铁的磁性材料出现。生产钕铁硼磁铁的主要原材料有稀土金属钕、纯铁、铝、硼以及其它稀土原料。
(1)钕(Nd)为60号元素,在元素周期表中的位置是___;
(2)实验测得气态A1C13的实际存在形式为A12C16双聚分子,其中A1原子的杂化方式是___;A12C16与过量NaOH溶液反应生成Na[Al(OH)4];[A1(OH)4]-中存在的化学键有___。
A.离子键 B.共价键 C.配位键 D.金属键 E.氢键
(3)已知立方BN晶体晶胞结构如图所示,设晶胞中最近的B、N原子之间的距离为a nm,晶体的密度为b gcm-3,则阿伏加德罗常数为____mol-1 (列式即可)
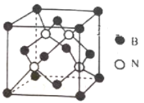
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列反应的离子方程式正确的是
A.钠与水的反应: Na+2H2O =Na++2OH-+H2↑
B.氯化铵固体与熟石灰共热制氨气:NH4++OH-![]() NH3↑+H2O
NH3↑+H2O
C.氯气通入石灰乳中制漂白粉:Cl2+2OH-=Cl-+ClO-+H2O
D.食醋除水垢:CaCO3+ 2CH3COOH = Ca2+ + 2CH3COO- + CO2↑+H2O
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】以NA代表阿伏加德罗常数,则关于热化学方程式C2H2(g)+![]() O2 (g)→2CO2 (g)+H2O(l) △H =-1300kJ/mol 的说法中,正确的是( )
O2 (g)→2CO2 (g)+H2O(l) △H =-1300kJ/mol 的说法中,正确的是( )
A.当1 NA个水分子生成且为液体时,吸收1300kJ的能量
B.当10 NA个电子转移时,该反应放出1300kJ的能量
C.当2 NA个碳氧共用电子对生成时,放出1300kJ的能量
D.当4 NA个碳氧共用电子对生成时,放出1300kJ的能量
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在一定温度下,向一容积不变的密闭容器中加入1 mol X气体和2mol Y气体,发生如下反应: X(g)+2Y(g)![]() 2Z(g) ,此反应达到平衡的标志是 )
2Z(g) ,此反应达到平衡的标志是 )
A.容器内气体密度不随时间变化
B.容器内压强不随时间变化
C.容器内X、Y、Z的浓度之比为l :2 :2
D.单位时间消耗0.1 mol X同时生成0.2 mol Z
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】在温度T1和T2时,分别将0.5molCH4和1.2molNO2充入体积为1L的密闭容器中,发生反应: CH4(g)+2NO2(g)![]() N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
N2(g)+CO2(g)+2H2O(g),测得有关数据如表:
时间/min | 0 | 10 | 20 | 40 | 50 | |
T1 | n(CH4)/mol | 0.50 | 0.35 | 0.25 | 0.10 | 0.10 |
T2 | n(CH4)/mol | 0.50 | 0.30 | 0.18 | …… | 0.15 |
下列说法正确的是
A.T1时0~10minNO2的平均反应速率为0.15mol·L-1·min-1
B.T2时CH4的平衡转化率为70.0%
C.保持其他条件不变,T1时向平衡体系中再充入0.3molCH4和0.80molH2O(g),平衡向正反应方向移动
D.保持其他条件不变,T1时向平衡体系中再充入0.5molCH4和1.2molNO2,与原平衡相比,达新平衡时N2的浓度增大
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】工业废催化剂中含有多种金属元素,某废催化剂主要含有SiO2、ZnO、ZnS和CuS,为充分利用资源,变废为宝,在实验室中探究回收废催化剂中的锌和铜,具体流程如图所示,回答下列问题:
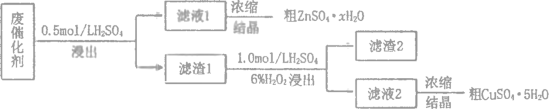
已知:ZnS与稀硫酸反应且化合价不变;CuS既不溶于稀硫酸也不与稀硫酸反应。
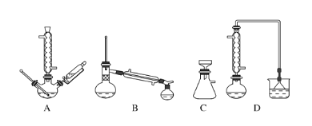
(1)下列玻璃仪器或装置中,第一次浸出时尾气净化需要使用的装置为___________(填标号),“浓缩结晶”需要使用的仪器是_______________(填名称)。
(2)滤渣1的主要成分是 ___________。
(3)第二次浸出时,向盛有滤渣1的反应器中先加入稀硫酸,后滴入过氧化氢溶液。反应器中有淡黄色沉淀生成,写出反应的离子方程式___________;若顺序相反,会造成___________。
(4)第二次浸出时需要加热且控温,采用的合适加热方式是___________。
(5)某同学在实验完成之后,得到23.3g提纯的硫酸锌晶体(ZnSO4·xH2O)。为确定晶体化学式,取5.0g晶体,用蒸馏水完全溶解.再加入足量的氯化钡溶液,充分反应后过滤、___________、___________、称重得固体4.1g,则硫酸锌晶体的化学式为___________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列图示与对应的叙述相符的是( )
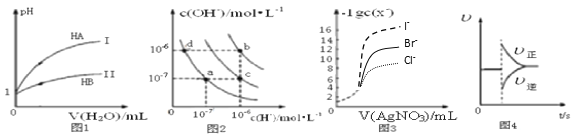
A. 图1表示常温下,稀释HA、HB两种酸的稀溶液时,溶液pH随加水量的变化,则等物质的量浓度的NaA和NaB混合溶液中:c(Na+)>c(A-)>c(B-)>c(OH-)>c(H+)
B. 图2中在b点对应温度下,将pH=2的H2SO4溶液与pH=12的NaOH溶液等体积混合后,溶液显中性
C. 用0.0100 mol/L硝酸银标准溶液,滴定浓度均为0.1000 mol/L Cl-、Br-及I-的混合溶液,由图3曲线,可确定首先沉淀的是Cl-
D. 图4表示在N2(g)+3H2(g) ![]() 2NH3(g)达到平衡后,减小NH3浓度时速率的变化
2NH3(g)达到平衡后,减小NH3浓度时速率的变化
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com