
����Ŀ����1��������������������Ʊ�����______________________________ ��
��2����Na2CO3��10H2O��������0.10 mol/L Na2CO3��Һ480 mL��
��ʵ��ʱҪ�õ��������У���������ƽ����Ͳ���ձ�������������ͷ�ι��⣬���ٻ������õ���һ�ֲ���������___________________����ʹ�ø�����ǰ������� �IJ�����_____________,����ȡʵ����Ҳ��Ҫ�ò�����������_____________��
����������ƽ��ȡNa2CO3��10H2O���������Ϊ___________g��
��������Һʱ�����¼���������
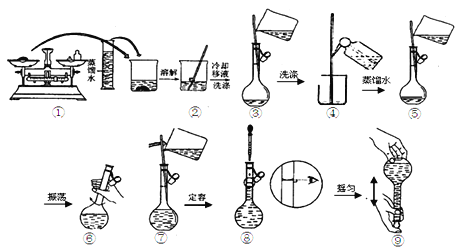
���ƹ����У����в�����������Һ��Ũ����ʲôӰ�죬�����ա�
a��Na2CO3��10H2O���岻��������NaCl
b�����������ij���������������
c������ƿ��ϴ����δ�����������ˮ
d��δ��ȴ�����¾�ת�ƶ���
e��������ˮʱ���������˿̶��ߣ������ý�ͷ�ιܽ������ˮ����
f������ʱ�����ӿ̶���
������������Һ��Ũ��ƫ�����________����Ӱ�����________������ţ���
���𰸡����ˮ����μ��뼸�α����Ȼ�����Һ��������������Һ�ʺ��ɫ 500mL����ƿ ��© ��Һ©�� 14.3 df c
��������
��1��ʵ�����Ʊ�������������ķ��������ˮ����μ��뼸�α����Ȼ�����Һ��������������Һ�ʺ��ɫ���õ������������壬��Ӧ�Ļ�ѧ����ʽΪ��FeCl3+3H2O�TFe(OH)3�����壩+3HCl��
��2������������ƿ�Ĺ��û��480mL�ģ�����Ӧ������500mL������Ҫ500mL����ƿ����ʹ������ƿǰ������м�©������ȡʵ����Ҳ��Ҫ���м�©�����Ƿ�Һ©����
����������ƽ��ȡNa2CO3��10H2O���������Ϊ0.1mol/L��0.5L��286g/mol=14.3g��
��a��Na2CO3��10H2O���岻��������NaCl�����ʵ���ƫ�٣�������ҺŨ��ƫС��b�����������������ij��������������壬��������������Ϊ13.7g��ƫ�٣�������ҺŨ��ƫС��c������ʱ��Ҫ������ˮ��������ƿ��ϴ����δ�����������ˮ����������Һ��Ũ����Ӱ�죻d��δ��ȴ�����¾�ת�ƶ��ݣ���ȴ����Һ�����С�������ӵ�ˮƫ�٣�������Һ��Ũ��ƫ��e��������ˮʱ���������˿̶��ߣ������ý�ͷ�ιܽ������ˮ������������ˮƫ�࣬������ҺŨ��ƫС��f������ʱ�����ӿ̶��ߣ�����ƫС��ˮ�������ˣ�������ҺŨ��ƫ�����ϣ�������������Һ��Ũ��ƫ�����df����Ӱ�����c��



| �꼶 | ���пγ� | �꼶 | ���пγ� |
| ��һ | ��һ��ѿγ��Ƽ��� | ��һ | ��һ��ѿγ��Ƽ��� |
| �߶� | �߶���ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
| ���� | ������ѿγ��Ƽ��� | ���� | ������ѿγ��Ƽ��� |
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����0.06mol FeCl2����100mL K2Cr2O7��Һ�У�ǡ��ʹ��Һ��Fe2+ȫ��ת��ΪFe3+ �� Cr2O72������ԭΪCr3+ �� ��K2Cr2O7��Һ�����ʵ���Ũ��Ϊ�� ��
A.0.4mol/L
B.0.2mol/L
C.0.1mol/L
D.0.08mol/L
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��������8�־��壬����Żش��������⣺
A��ˮ�� B������ C�������� D����̬� E���Ȼ�� F���� G�����ʯ
��1�����зǼ��Լ���ԭ�Ӿ�����_________ ,����ԭ�Ӿ���Ļ�������_______��������ѧ���ķ��Ӿ����� _______�����ڷ��Ӿ���ĵ�����_________
��2���������Ӽ������ۼ�����λ���Ļ�������___________�������ۻ�����˷����ۼ�����___________��
��3�����ɰ��SiC���Ľṹ����ʯ���ƣ�Ӳ������ʯ�൱������ɰ�ľ����к���_____����ԭ�ӣ�______��̼ԭ�ӣ����ʯ�۵���ڽ��ɰ��ԭ��_____________________________________
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.������(H3PO2) ��һ�־�ϸ������Ʒ�����н�ǿ��ԭ��:
��1��H3PO2��һԪ��ǿ�ᣬд������뷽��ʽ_____________��
��2��H3PO2 ��NaH2PO2 ���ɽ���Һ�е�Ag+��ԭΪ�����Ӷ������ڻ�ѧ����������H3PO2 ���л�ѧ������Ӧ�У�����������ΪH3PO4 ʱ���������뻹ԭ�������ʵ���֮��Ϊ_____.
��.��ҵ�ϲ�����������ȥ��������(��Ҫ�ɷ�ΪFe2O3��FeO��SiO2��Al2O3,��������������)����ȡ��ˮ����������(FeSO4��7H2O),������ͼ:

��3����ԭʱ���Լ�X ��ѡ��SO2����Ӧ�����������__________(�ѧʽ)��
��4���ӷ���������������Һ�еõ���Ʒ��Ӧ���еIJ�����_____��______�����ˡ�ϴ�ӡ����
��5����ˮ����������(FeSO4��7H2O) ��ҽѧ�ϳ�������Ѫ����ij����С��ͨ������ʵ�鷽���ⶨij��Ѫ�����������ӵĺ�����
����a: ȡ10Ƭ��Ѫ����Ʒ��ȥ���¡���ĥ���ܽ⡢���ˣ�����Һ���250mL ��Һ;
����b: ȡ������Һ25mL ����ƿ�У���������ϡ�����ữ���μ�0.010mol/L ��KMnO4
��Һ����ǡ����ȫ��Ӧ����¼���ĵ�KMnO4 ��Һ�����(�ٶ�ҩƷ�������ɷֲ���KMnO4 ��Ӧ)�������ķ�ӦΪ:MnO4-+5Fe2++8H+=5Fe3++Mn2++4H2O;
����c: �ظ�������b��2~3 �Σ�ƽ������KMnO4 ��Һ20.00mL��
�ٲ���a ��������Һʱ��Ҫ�IJ����������ձ�����ͷ�ι��⣬����Ҫ____��____��
�ڸò�Ѫ�����������ӵĺ���Ϊ__________mg/Ƭ��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����.��ѧƽ��֪ʶ:
��1�������������˹��̵������о��������ڳ��¡���ѹ�����������£�N2�ڴ���(��������Fe2O3��TiO2)������ˮ������Ӧ:
2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g) ��H=1530 kJ/mol,
4NH3(g)+3O2(g) ��H=1530 kJ/mol,
H2O(g)=H2O(1)��H=-44.0kJ/mol,
��4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ��H=______kJ/mol���ں��º����ܱ������У����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е���_____(����ĸ)
2N2(g)+6H2O(g) ��H=______kJ/mol���ں��º����ܱ������У����÷�Ӧ����ƽ��״̬ʱ����ʹƽ��������Ӧ�����ƶ��ҷ�Ӧ���ʼӿ죬���д�ʩ���е���_____(����ĸ)
A.��ƽ�������г���Ar B.��ƽ�������г���O2
C.���ø��õĴ��� D.���ͷ�Ӧ���¶�
��2�����ð�����ȡ����[CO(NH2)]�ķ�ӦΪ:2NH3(g)+CO2(g)![]() CO(NH2)2+H2O(g)��H<0,ij�¶��£�������Ϊ1L ���ܱ�������ͨ��4molNH3 ��2molCO2,�÷�Ӧ���е�40% ʱ���ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ��ǰ25s��NH3 ��Ũ����ʱ��ı仯���������������������������ʹ�ô�����������ͼ����ʵ����c(NH3)��ʱ��ı仯����____________
CO(NH2)2+H2O(g)��H<0,ij�¶��£�������Ϊ1L ���ܱ�������ͨ��4molNH3 ��2molCO2,�÷�Ӧ���е�40% ʱ���ﵽƽ�⣬��ʱCO2��ת����Ϊ50%����ͼ�е����߱�ʾ��ǰ25s��NH3 ��Ũ����ʱ��ı仯���������������������������ʹ�ô�����������ͼ����ʵ����c(NH3)��ʱ��ı仯����____________
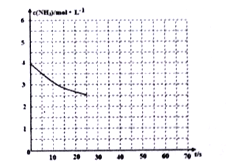
���������¶Ⱥ�����������䣬��ƽ����ϵ����ͨ��2molNH3 ��2molH2O,��ʱv��____v ��(����>������=������<��)
��3���ǰ�NH2OH ���Կ�����NH3�����ڵ�һ����ԭ�ӱ��ǻ�ȡ��������������ᡢ����ˮ��Һ������ʽ��е�⣬�ڹ��缫��NO3��ת��ΪNH2OH,�Բ�Ϊ��һ������õ�ⷴӦ���ܻ�ѧ����ʽ_______.
��.��Һ�е���Ϊ:
��4�������£���20 mL 0.2 mol/LH2A ��Һ�еμ�0.2 mol/LNaOH ��Һ���й������ʵ����仯����ͼ��ʾ��
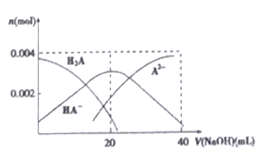
��v(NaOH)=20mL ʱ����Һ������Ũ�ȴ�С��ϵ:____________.
��5������Cr2O72-�ķ�ˮ���Խϴ�ij������ˮ�к�5.0��10-3mol/L��Cr2O72-��Ϊ��ʹ��ˮ���ŷŴ�꣬�������´���:
![]()
�ٸ÷�ˮ�м����̷�(FeSO4��7H2O)��H+��������Ӧ�����ӷ���ʽΪ___________��
����������ķ�ˮ�в�����c(Fe3+)=2.0��10-13mol/L���������Cr3+��Ũ��Ϊ______��(��֪:Ksp[Fe(OH)3 ]=4.0��10-38��Ksp[Cr(OH)3]=6.0��10-31)
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ�������ڷ�����ᴿ���ʵķ����У����ˡ������ᾧ��������ȡ����Һ��ϴ������������������װ�õ���ţ�
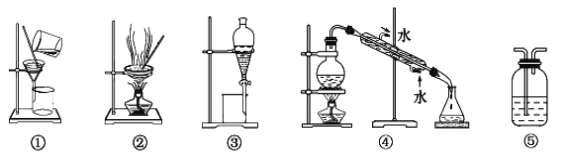
��1������Na2CO3��Һ��CCl4��ѡ_____������ţ�����������Ϊ________��
��2��������������Һ����O2�л��е�����Cl2��ѡ_______����������Ϊ________��
��3����ȥ����ʯ��ˮ��������CaCO3����ѡ______����������Ϊ__________��
��4����ȡ����ˮ��ѡ________����������Ϊ________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ��ij������Է�������Ϊ86����������к���3����CH3��2����CH2����1��![]() ����ýṹ������һ��ȡ�����������м����������������칹��
����ýṹ������һ��ȡ�����������м����������������칹��
A��9�� B��6�� C��5�� D��4��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����1���ýྻ���ձ�ȡ��������ˮ���þƾ��Ƽ��������ڣ����ձ�����μ��뱥�͵�FeCl3��Һ��������У�����Һ�ʺ��ɫֹͣ���ȡ�
��д���÷�Ӧ����ʽ________________________________________��
��֤���÷�ɢϵ�ǽ������ʵ���������________________________��
��2�����ڷ�Ӧ2CO��O2=2CO2���ڱ�״���£�4.48 Lһ����̼������������������Ӧ�����ɵĶ�����̼���Ӹ�����__________________��
��3������һ��Ȫˮ��Ʒ��1.0 L����Ȫˮ����4.8��10-2 g Mg2+����ô����Ȫˮ��Mg2+�����ʵ���Ũ����_______________����1.0 mol Mg2+������Ȫˮ�������_______________��
�鿴�𰸺ͽ���>>
��Ŀ�����л�ѧ ��Դ�� ���ͣ�
����Ŀ����±����Ҫ�ɷ�Ϊ��IIA��Ԫ�ص��Ȼ�����Ȼ���Ϊ
A. A1Cl3 B. CuCl2
C. FeCl3 D. MgCl2
�鿴�𰸺ͽ���>>
����ѧУ��ѡ - ��ϰ���б� - �����б�
����ʡ������Υ���Ͳ�����Ϣ�ٱ�ƽ̨ | �����к���Ϣ�ٱ�ר�� | ����թƭ�ٱ�ר�� | ����ʷ���������к���Ϣ�ٱ�ר�� | ������Ȩ�ٱ�ר��
Υ���Ͳ�����Ϣ�ٱ��绰��027-86699610 �ٱ����䣺58377363@163.com