
【题目】Ⅰ.化学平衡知识:
(1)根据最新“人工固氮”的研究报道,在常温、常压、光照条件下,N2在催化剂(掺有少量Fe2O3和TiO2)表面与水发生反应:
2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g) ΔH=1530 kJ/mol,
4NH3(g)+3O2(g) ΔH=1530 kJ/mol,
H2O(g)=H2O(1)ΔH=-44.0kJ/mol,
则4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=______kJ/mol。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____(填字母)
2N2(g)+6H2O(g) ΔH=______kJ/mol。在恒温恒容密闭容器中,当该反应处于平衡状态时,欲使平衡向正反应方向移动且反应速率加快,下列措施可行的是_____(填字母)
A.向平衡混合物中充入Ar B.向平衡混合物中充入O2
C.采用更好的催化剂 D.降低反应的温度
(2)①用氨气制取尿素[CO(NH2)]的反应为:2NH3(g)+CO2(g)![]() CO(NH2)2+H2O(g)ΔH<0,某温度下,向容器为1L 的密闭容器中通入4molNH3 和2molCO2,该反应进行到40% 时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3 的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线____________
CO(NH2)2+H2O(g)ΔH<0,某温度下,向容器为1L 的密闭容器中通入4molNH3 和2molCO2,该反应进行到40% 时,达到平衡,此时CO2的转化率为50%。下图中的曲线表示在前25s内NH3 的浓度随时间的变化。如果保持其他条件不变的情况下使用催化剂,请在下图中用实线画出c(NH3)随时间的变化曲线____________
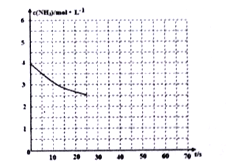
②若保持温度和容器体积不变,向平衡体系中再通入2molNH3 和2molH2O,此时v正____v 逆(填“>”、“=”或“<”)
(3)羟胺NH2OH 可以看作是NH3分子内的一个氢原子被羟基取代的衍生物。以硝酸、硫酸水溶液作电解质进行电解,在汞电极上NO3可转化为NH2OH,以铂为另一极,则该电解反应的总化学方程式_______.
Ⅱ.溶液中的行为:
(4)常温下,向20 mL 0.2 mol/LH2A 溶液中滴加0.2 mol/LNaOH 溶液。有关微粒物质的量变化如下图所示。
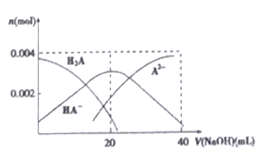
则当v(NaOH)=20mL 时,溶液中离子浓度大小关系:____________.
(5)含有Cr2O72-的废水毒性较大,某工厂废水中含5.0×10-3mol/L的Cr2O72-。为了使废水的排放达标,进行如下处理:
![]()
①该废水中加入绿矾(FeSO4·7H2O)和H+,发生反应的离子方程式为___________。
②若处理后的废水中残留的c(Fe3+)=2.0×10-13mol/L,则残留的Cr3+的浓度为______。(已知:Ksp[Fe(OH)3 ]=4.0×10-38,Ksp[Cr(OH)3]=6.0×10-31)
【答案】 -1266 B 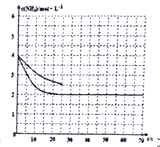
![]() 2HNO3+2H2O
2HNO3+2H2O![]() 2NH2OH+3O2↑ c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 3.0×10-6mol/L
2NH2OH+3O2↑ c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-) Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 3.0×10-6mol/L
【解析】(1)①2N2(g)+6H2O(1) ![]() 4NH3(g)+3O2(g) ΔH=1530 kJ/mol;②H2O(g)=H2O(1) ΔH=-44.0kJ/mol,则根据盖斯定律:-(①+②))可以得到:4NH3(g)+3O2(g)
4NH3(g)+3O2(g) ΔH=1530 kJ/mol;②H2O(g)=H2O(1) ΔH=-44.0kJ/mol,则根据盖斯定律:-(①+②))可以得到:4NH3(g)+3O2(g)![]() 2N2(g)+6H2O(g) ΔH=-1266 kJ/mol;向平衡混合物中充入Ar,在恒容密闭容器中,各组分浓度不变,所以速率不变,平衡不动,A错误;向平衡混合物中充入
2N2(g)+6H2O(g) ΔH=-1266 kJ/mol;向平衡混合物中充入Ar,在恒容密闭容器中,各组分浓度不变,所以速率不变,平衡不动,A错误;向平衡混合物中充入![]() ,正逆反应速率加快,平衡正向移动,B正确;采用更好的催化剂不会改变化学平衡移动,只是会加快反应速率,C错误;降低反应的温度会降低反应速率,D错误;正确答案: -1266 ; B。
,正逆反应速率加快,平衡正向移动,B正确;采用更好的催化剂不会改变化学平衡移动,只是会加快反应速率,C错误;降低反应的温度会降低反应速率,D错误;正确答案: -1266 ; B。
(2)①向容器为1L 的密闭容器中通入4molNH3 和2molCO2,该反应该反应进行到![]() 时达到平衡,此时此时CO2的转化率为50%;根据反应分析如下:
时达到平衡,此时此时CO2的转化率为50%;根据反应分析如下:
2NH3(g)+CO2(g)![]() CO(NH2)2+H2O(g)
CO(NH2)2+H2O(g)
起始浓度 4 2 0 0
变化浓度 2 1 1 1
平衡浓度 2 1 1 1
加入催化剂,不会改变化学平衡移动,但是会加快反应速率,得到前25s ![]() 随时间的变化曲线如下图所示:
随时间的变化曲线如下图所示: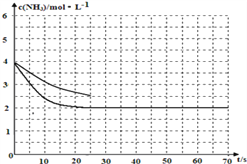 ;正确答案:
;正确答案: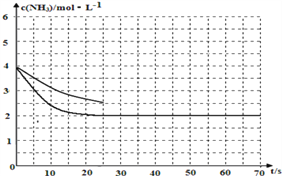 。
。
②上述反应的平衡常数为K=c(H2O)/ c(NH3)×c(CO2)=1/4=0.25;若保持其他条件不变,向平衡体系中再通入2molNH3 和2molH2O,此时![]() ,所以平衡会正向移动, v正大于v 逆,正确答案:>。
,所以平衡会正向移动, v正大于v 逆,正确答案:>。
(3)![]() 转化为
转化为![]() ,氮元素化合价降低,酸性条件下,
,氮元素化合价降低,酸性条件下,![]() 得电子,发生还原反应,则阴极反应为
得电子,发生还原反应,则阴极反应为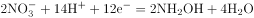 ,溶液中水失电子生成氧气,酸性条件下,阳极反应为
,溶液中水失电子生成氧气,酸性条件下,阳极反应为![]() ,所以电解反应的总化学方程式为
,所以电解反应的总化学方程式为![]() 。正确答案:
。正确答案:![]() 。
。
Ⅱ.(4)当v(NaOH)=20mL 时,发生反应为![]() ,溶液主要为NaHA,
,溶液主要为NaHA,![]() 电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-); 正确答案:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
电离大于水解,溶液显酸性,则c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-); 正确答案:c(Na+)>c(HA-)>c(H+)>c(A2-)>c(OH-)。
(5)①酸性条件下,![]() 具有强氧化性,可氧化
具有强氧化性,可氧化![]() ,反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ,正确答案: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 。
,反应的离子方程式为Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O ,正确答案: Cr2O72-+6Fe2++14H+=2Cr3++6Fe3++7H2O 。
②若处理后的废水中残留的![]()
![]() ,
,![]()
![]() ,计算得到
,计算得到![]() ,则残留的
,则残留的![]() 的浓度为
的浓度为![]() ,
,![]()
![]() ;正确答案3.0×10-6mol/L。
;正确答案3.0×10-6mol/L。


 一线名师提优试卷系列答案
一线名师提优试卷系列答案科目:高中化学 来源: 题型:
【题目】若NA表示阿伏加德罗常数,下列说法中,正确的是( )
A. 1 mol Cl2作为氧化剂得到的电子数为NA
B. 在0 ℃,101 kPa时,22.4 L氢气中含有NA个氢原子
C. 25 ℃,1.01×105Pa,64 g SO2中含有的原子数为3NA
D. 将0.1 mol FeCl3加到沸水中制得的胶体中,含胶粒0.1NA
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】三个密闭容器中分别充入N2、H2、O2三种气体,以下各种情况下排序正确的是( )
A. 当它们的温度和压强均相同时,三种气体的密度:ρ(H2)>ρ(N2)>ρ(O2)
B. 当它们的温度和密度都相同时,三种气体的压强:p(H2)>p(N2)>p(O2)
C. 当它们的质量和温度、压强均相同时,三种气体的体积:V(O2)>V(N2)>V(H2)
D. 当它们的压强和体积、温度均相同时,三种气体的质量:m(H2)>m(N2)>m(O2)
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列各组物质在一定条件下反应,可以制得较纯净的1,2—二氯乙烷的是
A.乙烷与氯气光照反应B.乙烯与氯气加成
C.乙烯与氯化氢气体加成D.乙烯通入浓盐酸中
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)简述氢氧化铁胶体的制备方法______________________________ 。
(2)用Na2CO3·10H2O晶体配制0.10 mol/L Na2CO3溶液480 mL。
①实验时要用到的仪器有:除托盘天平、量筒、烧杯、玻璃棒、胶头滴管外,至少还必须用到的一种玻璃仪器是___________________,在使用该仪器前必须进行 的操作是_____________,在萃取实验中也需要该操作的仪器是_____________;
②用托盘天平称取Na2CO3·10H2O晶体的质量为___________g;
③配制溶液时有以下几个操作:
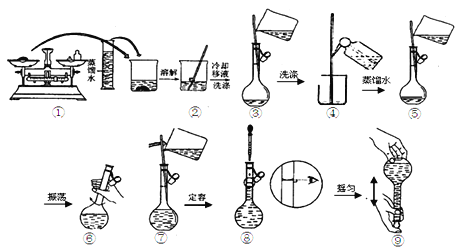
配制过程中,下列操作对所配溶液的浓度有什么影响,完成填空。
a.Na2CO3·10H2O晶体不纯,混有NaCl
b.用“左码右物”的称量方法称量晶体
c.容量瓶中洗净后未干燥,残留少量水
d.未冷却至室温就转移定容
e.加蒸馏水时不慎超过了刻度线,立即用胶头滴管将多余的水吸出
f.定容时,俯视刻度线
会引起所配溶液的浓度偏大的有________,无影响的有________(填序号)。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】(1)现有32 g某气体,摩尔质量为16 g·mol-1,则:
①该气体为___________ mol。
②该气体所含分子数为___________ NA。
③该气体在标准状况下的体积为_________ L。
(2)实验室常用浓盐酸的质量分数为36.5%,密度为1.16g·mL-1,其物质的量浓度是_______
(3)若标况下X2的密度为1.43 g/L,X原子最外层有_____个电子。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】某种碳酸锰矿的主要成分有MnCO3、MnO2、FeCO3、MgO、SiO2、Al2O3等。已知碳酸锰难溶于水。一种运用阴离子膜电解法的新技术可用于从碳酸锰矿中提取金属锰,流程如下:

(1)写出用稀硫酸溶解碳酸锰反应的离子方程式______________________________。
(2)已知不同金属离子生成氢氧化物沉淀所需的pH如下表:
离子 | Fe3+ | Al3+ | Fe2+ | Mn2+ | Mg2+ |
开始沉淀的pH | 2.7 | 3.7 | 7.0 | 7.8 | 9.3 |
沉淀完全的pH | 3.7 | 4.7 | 9.6 | 9.8 | 10.8 |
①流程中先加双氧水的目的是__________________________________________。
②加氨水调节溶液的pH等于6,则滤渣的成分是__________________,滤液中含有的阳离子有H+ 和___________________。
(3)在浸出液里锰元素只以Mn2+ 的形式存在,且滤渣中也无MnO2,请解释原因_________。
(4)阴离子膜法电解装置如右图所示,电解装置中箭头表示溶液中阴离子移动的方向,则A电极是______极。实际生产中,阳极以稀硫酸为电解液,阳极的电极反应式为__________________________。

(5)该工艺之所以采用阴离子交换膜,是为了防止Mn2+ 进入阳极区发生副反应生成MnO2造成资浪费,写出该副反应的电极反应式________________________________。
查看答案和解析>>
科目:高中化学 来源: 题型:
【题目】下列说法正确的是
A. Na2CO3溶液显碱性,NaHCO3溶液显酸性
B. 可用加热方法除去NaHCO3固体中的Na2CO3杂质
C. 用Ba(OH)2溶液能鉴别碳酸钠和碳酸氢钠溶液
D. 等质量的Na2CO3、NaHCO3固体分别与足量盐酸反应,后者产生的CO2多
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com