
| A. | 常温常压下,11.2 LCO2所含的分子数为0.5NA | |
| B. | 标准状况下,22.4 L 酒精中所含分子数为NA | |
| C. | 标准状况下,18g H2O所含原子数为NA | |
| D. | 常温常压下,48g O2与O3混合物含有的氧原子数为3NA |
分析 A.常温常压下,气体摩尔体积大于22.4L/mol;
B.标准状况酒精不是液体;
C.标准状况下,18g H2O物质的量=$\frac{18g}{18g/mol}$=1mol,1mol水中含原子3mol;
D.氧气和臭氧中只含有氧原子,48g臭氧和氧气的混合物中含有48g氧原子,含有3mol氧原子;
解答 解:A、常温常压下,气体摩尔体积大于22.4L/mol,故11.2LCO2的物质的量小于0.5mol,则分子个数小于0.5NA个,故A错误;
B.标准状况下,22.4 L 酒精中所含分子数不是NA,故B错误;
C.标准状况下,18g H2O物质的量=$\frac{18g}{18g/mol}$=1mol,所含原子数为3NA,故C错误;
D.48gO3和O2的混合物含有48g氧原子,含有氧原子的物质的量为:$\frac{48g}{16g/mol}$=3mol,含有的氧原子数为3NA,故D正确;
故选D.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,题目难度不大.


 课堂练加测系列答案
课堂练加测系列答案 轻松课堂单元测试AB卷系列答案
轻松课堂单元测试AB卷系列答案科目:高中化学 来源: 题型:选择题
| A. | 氧化铁可用来制造红色油漆和涂料 | |
| B. | 生铁、普通钢和不锈钢中的含碳量依次减小 | |
| C. | 硅胶可用作实验室和袋装食品、瓶装药品等的干燥剂 | |
| D. | 硅是生产光纤制品的基本原料 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 氧化产物和还原产物的物质的量之比为2:1 | |
| B. | 转移4 mol电子时,只需向装置中通人44.8 L H2(标准状况) | |
| C. | 装药品之前加热装置至100℃并持续一会儿 | |
| D. | 制备硼氢化钠的副产物可能有NaH |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 2个 | B. | 3个 | C. | 4个 | D. | 5个 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
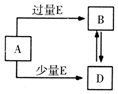 已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )
已知A、B、D、E均为中学化学中的常见物质,它们之间的转化关系如图所示(部分产物略去),则下列有关物质的推断不正确的是( )| A. | 若A是铁,则E可能为稀硝酸 | |
| B. | 若A是CuO,E是碳,则B为CO | |
| C. | 若A是NaOH溶液,E是CO2,则B为NaHCO3 | |
| D. | 若A是A1C13溶液,E可能是稀氨水 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
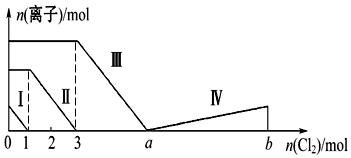
| A. | 线段Ⅱ表示Br-的变化情况 | B. | 原溶液中n(FeBr2):n(FeI2)=1:3 | ||
| C. | 线段Ⅳ表示IO3-的变化情况 | D. | 根据图象无法计算a的值 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 1molN2与4molH2反应生成的NH3分子数为2NA | |
| B. | 14g乙烯和丙烯混合气体中的氢原子数为2NA | |
| C. | 1 molFe溶于过量硝酸,电子转移数为2NA | |
| D. | 标准状况下,2.24LCCl4含有的共价键数为0.4NA |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com