
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:分析 (1)铜与浓硝酸反应中,圆底烧瓶中压强会迅速减小,将氢氧化钠溶液倒吸入反应装置,有了A装置就可以防止倒吸;
(2)关闭活塞b,打开活塞a,通入一段时间空气,将装置中的有毒气体导入氢氧化钠溶液中,让氢氧化钠溶液充分吸收;
(3)不生成氮的氧化物,消耗硝酸较少;
(4)洗涤可除去碱式碳酸铜表面的吸附的硝酸钠;
(5)根据碳酸钠溶液和硝酸铜溶液发生双水解,加热至70℃左右是促进水解,即用水浴加热.
解答 解:(1)由于铜与浓硝酸反应中,圆底烧瓶中压强会迅速减小,将氢氧化钠溶液倒吸入反应装置,有了A装置就可以防止倒吸,
故答案为:安全瓶,防倒吸;
(2)通过关闭活塞b,打开活塞a,通入一段时间空气操作,可以将装置中的有毒气体导入氢氧化钠溶液中,让氢氧化钠溶液充分吸收,
故答案为:关闭活塞b,打开活塞a,通入一段时间空气;
(3)不生成氮的氧化物,消耗硝酸较少,即此方法的优点是:污染小、消耗原料少,
故答案为:污染小、消耗原料少;
(4)通过洗涤可除去碱式碳酸铜表面的吸附的硝酸钠,
故答案为:洗去碱式碳酸铜表面吸附的Na+和NO3-;
(5)根据碳酸钠溶液和硝酸铜溶液发生双水解,加热至70℃左右是促进水解,即用水浴加热,
故答案为:水浴.
点评 本题借助制取碱式碳酸铜制法考查了实验方案设计知识在解题中的应用,充分考查了学生的分析、理解、计算能力,是一道不错的能力挑战题目,本题难度中等.


 学练快车道快乐假期寒假作业系列答案
学练快车道快乐假期寒假作业系列答案 新思维寒假作业系列答案
新思维寒假作业系列答案科目:高中化学 来源: 题型:选择题
| A. | 常温常压下,11.2 LCO2所含的分子数为0.5NA | |
| B. | 标准状况下,22.4 L 酒精中所含分子数为NA | |
| C. | 标准状况下,18g H2O所含原子数为NA | |
| D. | 常温常压下,48g O2与O3混合物含有的氧原子数为3NA |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
 乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.
乙二酸俗名草酸,下面是化学学习小组的同学对草酸晶体(H2C2O4•xH2O)进行的探究性学习的过程,请你参与并协助他们完成相关学习任务.查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 温度℃ | 400 | 500 | 830 | 1 000 |
| 平衡常数K | 10 | 9 | 1 | 0.6 |
| A | B | C | D | |
| n(CO2)/mol | 0 | 1 | 3 | 1 |
| n(H2)/mol | 0 | 2 | 2 | 1 |
| n(CO)/mol | 3 | 0.5 | 1 | 2 |
| n(H2O)/mol | 3 | 2 | 5 | 2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
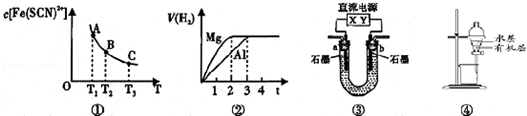
| A. | 已知图①是体系Fe3+(aq)+SCN-(aq)?Fe(SCN)2+(aq)中的c[Fe(SCN)2+]与温度T的平衡图象,A点与B点相比,A点的c(Fe3+)更小 | |
| B. | 图②表示镁和铝分别与等浓度、等体积的过量稀硫酸反应,产生气体的体积V 与时间t的关系.则反应中镁和铝的反应速率之比为2:3 | |
| C. | 图③直流电源Y极为正极,U形管中为AgNO3溶液,则b管中电极反应式是:4OH--4e-═O2↑+2H2O | |
| D. | 图④表示分离CCl4萃取碘水后已分层的有机层和水层 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| H-H | 436 | C-F | 427 | H-S | 339 |
| S=S | 255 | C-C1 | 330 | H-F | 565 |
| C1-C1 | 243 | C-I | 218 | H-C1 | 431 |
| O=O | ? | H-O | 464 | H-Br | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含一种元素的物质一定是单质 | B. | 只含一种分子的物质一定纯净物 | ||
| C. | 非金属氧化物一定是酸性氧化物 | D. | 有单质生成的反应一定是置换反应 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com