
| A. | 只含一种元素的物质一定是单质 | B. | 只含一种分子的物质一定纯净物 | ||
| C. | 非金属氧化物一定是酸性氧化物 | D. | 有单质生成的反应一定是置换反应 |
分析 A.只含一种元素的物质,可能是混合物;
B.纯净物是由一种物质组成;
C.非金属氧化物包含酸性氧化物、不成盐氧化物;
D.分解反应中有可能有单质生成.
解答 解:A.只含一种元素的物质,可能是混合物,如氧气和臭氧的混合物中只含有O元素,是混合物,不是单质,故A错误;
B.纯净物是由一种物质组成,则只含一种分子的物质一定纯净物,故B正确;
C.非金属氧化物包含酸性氧化物、不成盐氧化物,如CO是非金属氧化物,是不成盐氧化物,不是酸性氧化物,故C错误;
D.分解反应中有可能有单质生成,如高锰酸钾分解生成锰酸钾、二氧化锰和氧气,该反应是分解反应,不是置换反应,故D错误.
故选B.
点评 本题考查了物质的分类、基本反应类型的判断,要加强记忆混合物、纯净物、单质、化合物、氧化物等基本概念,并能够区分应用,题目难度不大.


 天天向上一本好卷系列答案
天天向上一本好卷系列答案 小学生10分钟应用题系列答案
小学生10分钟应用题系列答案科目:高中化学 来源: 题型:实验题
 碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:
碱式碳酸铜是一种化工原料,化学式用mCu(OH)2•nCuCO3表示.实验室以废铜屑为原料制取碱式碳酸铜的步骤如下:查看答案和解析>>
科目:高中化学 来源: 题型:解答题
| A | B | C | D | |
| 研究目的 | 压强对反应的影响(P2>P1) | 温度对反应的影响 | 平衡体系增加N2对反应的影响 | 催化剂对反应的影响 |
| 图示 | 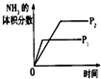 | 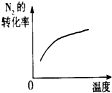 | 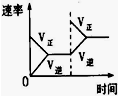 | 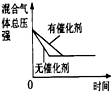 |
查看答案和解析>>
科目:高中化学 来源: 题型:实验题
| 实验次数 | 初读数(mL) | 末读数(mL) |
| 1 | 0.00 | 18.50 |
| 2 | 0.00 | 22.45 |
| 3 | 0.00 | 18.48 |
查看答案和解析>>
科目:高中化学 来源: 题型:多选题
| A. | Ba2+、SO42-,Fe3+、K+ | B. | OH-、C1-、Na+ | ||
| C. | NH4+、NO3-、A13+、K+ | D. | HCO3-、SO42-、Na+、H+ |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 硫化亚铁溶于稀硝酸中:FeS+2H+=Fe2++H2S↑ | |
| B. | NH4HCO3溶于过量的NaOH溶液中:HCO3-+OH-=CO32-+H2O | |
| C. | NaClO和NaOH的混合溶液中通入少量的SO2:ClO-+H2O+SO2=C1-+SO42-+2H+ | |
| D. | 大理石溶于醋酸中:CaCO3+2CH3COOH=Ca2++2CH3COO-+CO2↑+H2O |
查看答案和解析>>
科目:高中化学 来源: 题型:填空题
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 乙烯和乙醛均能使酸性KMnO4溶液褪色 |
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com