
| A. | 配制银氨溶液:在一定量AgNO3溶液中,滴加氨水至沉淀溶解 | |
| B. | 配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入少量NaOH溶液 | |
| C. | 制备氯乙烷(C2H5Cl):将乙烷和氯气的混合气放在光照条件下反应 | |
| D. | 乙烯和乙醛均能使酸性KMnO4溶液褪色 |
分析 A.在一定量AgNO3溶液中,滴加氨水至沉淀恰好溶解可制得银氨溶液;
B.配制Cu(OH)2悬浊液:在一定量CuSO4溶液中,加入过量NaOH溶液;
C.乙烷和氯气发生取代反应生成多种氯代烃且还生成HCl;
D.碳碳双键和醛基都能被酸性高锰酸钾溶液氧化.
解答 解:A.银氨溶液的配制方法:取一洁净试管,加入2 mL 2%的AgNO3溶液,再逐滴滴入2%的稀氨水,至生成的沉淀恰好溶解,故A错误;
B.新制Cu(OH)2悬浊液的配制方法:在试管里加入10%NaOH溶液2 mL,滴入2%CuSO4溶液4~6滴,故B错误;
C.乙烷和氯气发生取代反应生成多种氯代烃且还生成HCl,应该用乙烯和HCl发生加成反应生成氯乙烷,故C错误;
D.碳碳双键和醛基都能被酸性高锰酸钾溶液氧化而使酸性高锰酸钾溶液褪色,故D正确;
故选D.
点评 本题考查化学实验方案评价,为高频考点,涉及有机物性质、溶液配制、物质制备等知识点,明确化学反应原理、有机物性质是解本题关键,侧重考查学生实验操作、实验评价能力,注意银氨溶液和氢氧化铜悬浊液配制方法区别,题目难度不大.


科目:高中化学 来源: 题型:解答题
| 化学键 | 键能 | 化学键 | 键能 | 化学键 | 键能 |
| H-H | 436 | C-F | 427 | H-S | 339 |
| S=S | 255 | C-C1 | 330 | H-F | 565 |
| C1-C1 | 243 | C-I | 218 | H-C1 | 431 |
| O=O | ? | H-O | 464 | H-Br | 366 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 只含一种元素的物质一定是单质 | B. | 只含一种分子的物质一定纯净物 | ||
| C. | 非金属氧化物一定是酸性氧化物 | D. | 有单质生成的反应一定是置换反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题

| A. | 正反应吸热,m+n>x | B. | 正反应吸热,m+n<x | ||
| C. | 正反应放热,m+n<x | D. | 正反应放热,m+n>x |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | 此反应是氧化还原反应 | |
| B. | N2O4在反应中作还原剂 | |
| C. | 反应瞬间产生大量高温气体,推动火箭飞行 | |
| D. | R的分子式为C2H8N2 |
查看答案和解析>>
科目:高中化学 来源: 题型:选择题
| A. | NaOH与HCl 反应 | B. | CO与O2点燃 | ||
| C. | Ba(OH)2•8H2O与NH4NO3反应 | D. | SO3与H2O反应 |
查看答案和解析>>
科目:高中化学 来源: 题型:解答题
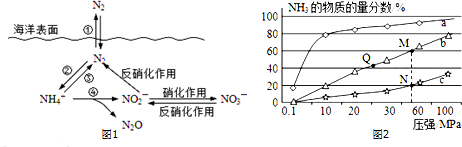
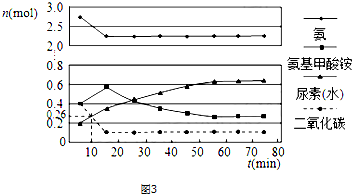
查看答案和解析>>
湖北省互联网违法和不良信息举报平台 | 网上有害信息举报专区 | 电信诈骗举报专区 | 涉历史虚无主义有害信息举报专区 | 涉企侵权举报专区
违法和不良信息举报电话:027-86699610 举报邮箱:58377363@163.com